题目内容
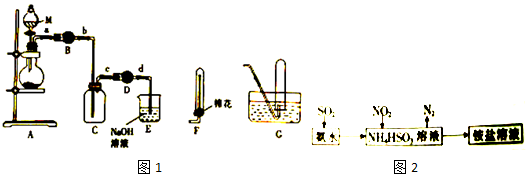
8. 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的在于检验装置气密性;
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;再由a向c中加2mL蒸馏水,c中实验现象为反应变缓,气体颜色变浅;
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙,理由是制取等量的硝酸铜时,丙方案耗酸量最少,无污染.
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
分析 (1)实验前要检查装置气密性;
(2)铜与浓硝酸反应得到硝酸铜、二氧化氮和水;二氧化氮能与水反应生成硝酸和一氧化氮;
(3)根据制备过程中耗酸量最少,无污染的原则进行判断;
(4)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,利用KMnO4与浓盐酸反应,再利用产生的氯气与KBr溶液反应得到溴,同时要注意尾气吸收.
解答 解:(1)实验前要检查装置气密性,这是检查装置气密性的常见方法,
故答案为:检查装置气密性;
(2)铜与浓硝酸反应得到硝酸铜、二氧化氮和水,方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;由a向c中加2mL蒸馏水,硝酸进行的稀释,反应变缓,同时二氧化氮能与水反应生成硝酸和一氧化氮,故c中气体颜色变浅,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应变缓,气体颜色变淡;
(3)甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,硝酸的利用率为50%;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,硝酸的利用率为75%;
丙:此过程用方程式可表示为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,
故能体现绿色化学理念的最佳方案是丙,
故答案为:丙;制取等量的硝酸铜时,丙方案耗酸量最少,无污染;
(4)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,利用KMnO4与浓盐酸反应:2KMnO4KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,
再利用产生的氯气与KBr溶液反应得到溴:Cl2+2KBr=2KCl+Br2,则实验操作为:向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸,所以c中有黄绿色气体产生,d中溶液变为橙色,尾气中含有有毒气体,要注意尾气吸收;
故答案为:向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液变为橙色;未处理尾气.
点评 本题考查了实验方案设计与评价,题目难度中等,侧重学生分析问题、解决问题的能力和绿色化学的观点的培养,注意把握Cu与硝酸反应、以及氮的氧化物的性质.

| A. | CH4+Cl2-→CH3Cl+HCI | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | nCH2═CH2-→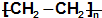 | |
| D. | CH3CH2OH+CH3COOH-→CH3COOCH2CH3+H2O |
| A. | C12H22O11 | B. | SO3 | C. | NaHCO3 | D. | Br2 |
| A. | 原CuSO4溶液的浓度为0.1mol/L | |
| B. | 反应过程中共转移0.02mol电子 | |
| C. | 向电解后的溶液中加入适量CuO,可恢复到原溶液 | |
| D. | 阳极周围溶液的pH减小 |
| A. | 蛋白质 | B. | 淀粉 | C. | 油脂 | D. | 纤维素 |
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C(碳) | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |