题目内容
【题目】现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式; 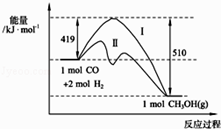
已知该反应中相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
则C≡O中的键能为KJmol﹣1;图中曲线Ⅱ表示(填反应条件)的能量变化.
【答案】CO(g)+2H2(g)=CH3OH(g)△H=﹣91kJ/mol;1084;提供催化剂
【解析】解:反应物的总能量与活化能的差值为419kJ,生成物的总能量与活化能的差值为510kJ,则该反应为放热反应,放出的热量为419kJ﹣510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJ/mol, 因为化学反应焓变=反应物键能总和﹣生成物键能总和,所以设C≡O中的键能为xKJ/mol,则﹣91=436×2+x﹣(413×3+343+465),解得x=1084KJ/mol,图中曲线Ⅱ表示降低了反应物的活化能,所以曲线Ⅱ表示提供催化剂的能量变化;所以答案是:CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJ/mol;1084;提供催化剂.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.

练习册系列答案
相关题目