题目内容
【题目】过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是_____。
A.铜元素焰色反应的光谱为吸收光谱
B.金属键没有方向性和饱和性
C.基态铁原子核外未成对电子有4个
D.锌属于过渡元素,处于元素周期表的d区
(2)[Co(NH3)5Br](NO3)3是钻元素形成的一种配位化合物。
①该配位化合物中心离子的价电子排布式为___,中心离子的配位数为____。
②该配位化合物中含氮离子的中心原子的杂化类型为______。
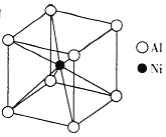
(3)①一种铝镍合金的结构如图,与其结构相似的化合物是_____。
a.氯化钠
b.氯化铯
c.石英
d.金刚石
②NiO、CoO的晶体结构均属于NaC1型(Ni2+和Co2+的半径分别为69pm和74pm),NiO的熔点比CoO高,其原因是____。
③已知CuO![]() Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
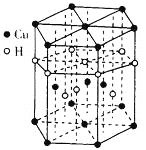
(4)Cu与H可形成一种红色晶体,其晶胞结构如图所示,则该化合物的化学式为____,一个晶胞的质量为_____g(NA为阿伏加德罗常数的值)。
【答案】BC 3d5 6 sp2 b NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大 Cu+的3d能级有10个电子,处于较稳定的全充满状态,则Cu2+不如Cu+稳定 CuH ![]()
【解析】
(1)A.焰色反应为原子的发射光谱;
B.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此金属键没有方向性和饱和性;
C.根据基态铁原子的价电子排布式为3d64s2判断;
D.根据元素在周期表的分区作答;
(2)①根据化合价代数和为零,判断钴离子的电荷数,从而确定其价电子排布式;其中NH3、Br-均为中心离子的配体,配位数为6;
②该配位化合物中含氮离子为NO3-,计算价层电子对数,即可判断中心原子的杂化类型;
(3)①根据“均摊法”确定铝镍合金的化学式,以及阴阳离子的配位数,再以此进行比较;
②离子晶体的晶格能越大,熔沸点越高;
③Cu+的3d能级有10个电子,处于较稳定的全充满状态,而Cu2+不如Cu+稳定;
(4)根据“均摊法”确定该晶体的化学式;再计算晶胞的质量。
(1)A.当金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因此铜元素焰色反应的光谱为发射光谱,A项错误;
B.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此金属键没有方向性和饱和性,B项正确;
C.基态铁原子的价电子排布式为3d64s2,在3d轨道上有4个未成对电子,C项正确;
D.锌属于过渡元素,处于元素周期表的ds区,D项错误;
故答案为:BC;
(2)①钴离子的化合价为+4价,钴离子核外有23个电子,其价电子排布式为3d5;
中心离子钴离子的的配位数为6;
故答案为:3d5;6;
②该配位化合物中含氮离子为NO3-,孤电子对数为(5+1-3×2)/2=0,σ键电子对数为3,,价层电子对数为3+0=3,则中心原子的杂化类型为sp2;
故答案为:sp2;
(3)①由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×1/8
=1,其化学式为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,a.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合;
b.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合;
c.石英为空间立体网状结构,硅原子周围有4个氧原子,氧原子周围有2个硅原子,不符合;
d.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合;
故答案为:b;
②NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大,则NiO的熔点比CoO高;
故答案为:NiO、CoO均为离子晶体,Ni2+、Co2+所带电荷数相同,Ni2+比Co2+的半径小,形成的离子键强,晶格能大;
③Cu+的3d能级有10个电子,处于较稳定的全充满状态,而Cu2+不如Cu+稳定;
故答案为:Cu+的3d能级有10个电子,处于较稳定的全充满状态;而Cu2+不如Cu+稳定;
(4)观察晶胞结构知,12个顶点上(顶点上原子为6个晶胞共用)各有一个Cu、上下两个面中心各有一个Cu、晶胞体内有3个Cu,则一个晶胞内Cu原子的个数为12×1/6+2×1/2+3=6;6个棱上(棱上原子为3个晶胞共用)各有一个H,体内有4个H,故一个晶胞内H原子的个数为6×1/3+4=6;则化学式为CuH,一个晶胞的质量为![]() ;
;
故答案为:CuH;![]() 。
。