题目内容
(14分)为研究盛装浓硫酸的铁质材料(碳素钢)与浓硫酸的反应,某学习小组进行了以下探究活动:
[实验]取一铁钉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为x中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)
KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性:KMn04溶液
②为分析气体成分,乙同学取448mL(标准状况)气体Y通人足量溴水中,发生的反应式 为:Br2+SO2+2H20====2HBr+H2S04,然后加入足量BaCl2溶液,经适当操作后得干燥 固体2.33 g
[提出猜想]
分析上述实验中SO2的体积分数的结果,同学们认为Y中还可能含有其它气体并作如下
猜测:
猜想一:Y气体中可能含有H2;
猜想二:
猜想三:
[设计实验,验证猜想]
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省
略)。
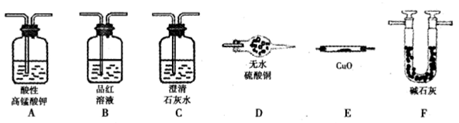
(1)实验装置连接次序为A→ → →F → →F
(2)装置B中试剂作用是 。
(3)猜想一的理由是 (用化学方程式表示)。
(4)如果猜想一成立,预计实验现象应该是 。
[实验]取一铁钉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为x中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)
KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性:KMn04溶液
②为分析气体成分,乙同学取448mL(标准状况)气体Y通人足量溴水中,发生的反应式 为:Br2+SO2+2H20====2HBr+H2S04,然后加入足量BaCl2溶液,经适当操作后得干燥 固体2.33 g
[提出猜想]
分析上述实验中SO2的体积分数的结果,同学们认为Y中还可能含有其它气体并作如下
猜测:
猜想一:Y气体中可能含有H2;
猜想二:
猜想三:
[设计实验,验证猜想]
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省
略)。

(1)实验装置连接次序为A→ → →F → →F
(2)装置B中试剂作用是 。
(3)猜想一的理由是 (用化学方程式表示)。
(4)如果猜想一成立,预计实验现象应该是 。
①d
②猜想二:Y气体中可能含有CO2;
猜想三:Y气体中可能含有H2和CO2
(1)B C E D
(2)检验SO2是否除尽
(3)Fe+H2SO4=FeSO4+H2↑
(4)E中固体由黑变红,D中固体由白变蓝色
②猜想二:Y气体中可能含有CO2;
猜想三:Y气体中可能含有H2和CO2
(1)B C E D
(2)检验SO2是否除尽
(3)Fe+H2SO4=FeSO4+H2↑
(4)E中固体由黑变红,D中固体由白变蓝色
①溶液为Fe3+和Fe2+离子的混合物,加入KSCN溶液和氯水、铁粉和KSCN溶液、浓氨水都不能检验亚铁离子的存在,亚铁离子具有还原性,高锰酸钾溶液呈紫色,具有氧化性,可与亚铁离子在酸性条件下反应二褪色,故答案为:d;
②除SO2外,根据反应:C+H2SO4(浓)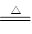 CO2↑+SO2↑+H2O Fe+H2SO4=FeSO4+H2↑可知,气体中可能含有CO2、H2,有三种情况:只有H2、只有CO2、两气体均有CO2、H2
CO2↑+SO2↑+H2O Fe+H2SO4=FeSO4+H2↑可知,气体中可能含有CO2、H2,有三种情况:只有H2、只有CO2、两气体均有CO2、H2
(1)根据铁钉(或碳素钢)中含有碳元素,推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,故答案为:B→C→F→E→D;
(2)CO2气体和SO2气体都能使澄清石灰水变浑浊,检验CO2气体的存在应先除去SO2气体并检验是否除尽,故答案为:检验SO2是否除尽;
(3)气体中如含有H2,发生的反应为Fe+H2SO4═FeSO4+H2↑,故答案为:Fe+H2SO4═FeSO4+H2↑;
(4)含有H2,与CuO在加热条件下反应生成铜和水,E中固体由黑色氧化铜生成红色铜,D中无色硫酸铜吸水生成五水硫酸铜蓝色晶体,故答案为:E中固体由黑变红,D中固体由白变蓝色.
②除SO2外,根据反应:C+H2SO4(浓)
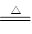 CO2↑+SO2↑+H2O Fe+H2SO4=FeSO4+H2↑可知,气体中可能含有CO2、H2,有三种情况:只有H2、只有CO2、两气体均有CO2、H2
CO2↑+SO2↑+H2O Fe+H2SO4=FeSO4+H2↑可知,气体中可能含有CO2、H2,有三种情况:只有H2、只有CO2、两气体均有CO2、H2(1)根据铁钉(或碳素钢)中含有碳元素,推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,故答案为:B→C→F→E→D;
(2)CO2气体和SO2气体都能使澄清石灰水变浑浊,检验CO2气体的存在应先除去SO2气体并检验是否除尽,故答案为:检验SO2是否除尽;
(3)气体中如含有H2,发生的反应为Fe+H2SO4═FeSO4+H2↑,故答案为:Fe+H2SO4═FeSO4+H2↑;
(4)含有H2,与CuO在加热条件下反应生成铜和水,E中固体由黑色氧化铜生成红色铜,D中无色硫酸铜吸水生成五水硫酸铜蓝色晶体,故答案为:E中固体由黑变红,D中固体由白变蓝色.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
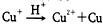 ,在NH4CuSO4中加入足量3mol/L硫酸后,下列叙述正确的是
,在NH4CuSO4中加入足量3mol/L硫酸后,下列叙述正确的是
 NaHSO4+HNO3↑。该反应说明
NaHSO4+HNO3↑。该反应说明