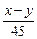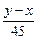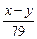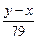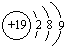题目内容
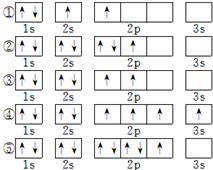
W、X、Y、Z是原子序数依次增大的短周期元素.W的最外层电子数是电子层数的2倍.Y是金属,可以和X形成原子个数比1:1和2:1两种化合物.Z的最高正价与最低负价的代数和为4.
(1)写出WX2的电子式______.
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序______>______>______.
(3)在一定量Y的最高价氧化物对应水化物的稀溶液中通入过量WX2,该反应的离子方程式为______;用离子浓度表示该溶液中的电荷守恒______.
(4)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1molY2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为______.
(1)写出WX2的电子式______.
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序______>______>______.
(3)在一定量Y的最高价氧化物对应水化物的稀溶液中通入过量WX2,该反应的离子方程式为______;用离子浓度表示该溶液中的电荷守恒______.
(4)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1molY2ZX4参加反应转移0.8mol电子,消耗标况下H2的体积为4.48L,该反应的化学方程式为______.
W、X、Y、Z是原子序数依次增大的短周期元素.Y是金属,可以和X形成1:1和2:1两种化合物,则Y为钠元素,X为氧元素;Z的最高正价与最低负价的代数和为4,则最外层有6个电子,处于ⅥA族,则Z为硫元素;W的最外层电子数是电子层数的2倍,氦、碳、硫符合,由于Z为硫元素,氦为稀有气体,结合问题可知不可能为氦,故W为碳元素.
故W为碳元素,Y为钠元素,X为氧元素;Z为硫元素.
(1)W为碳元素、X为氧元素,WX2是CO2,分子中碳元素与氧原子之间形成2对共用电子对,电子式为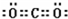 .
.
故答案为: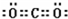 .
.
(2)X为氧元素,Y为钠元素,Z为硫元素,同周期自左而右原子半径减小,所以Na>S,同主族自上而下原子半径增大,所以S>O,故原子半径Na>S>O.
故答案为:Na>S>O.
(3)Y的最高价氧化物对应水化物NaOH,通入过量的二氧化碳,生成碳酸氢钠,反应离子方程式为OH-+CO2=HCO3-;
根据溶液呈电中性可知c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+).
故答案为:OH-+CO2=HCO3-;c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+).
(4)Na2SO4与CO、H2在高温和铁做催化剂条件下反应,0.1molNa2SO4参加反应转移0.8mol电子,硫元素被还原,令硫元素在还原产物化合价中化合价为x,则0.1×(6-x)=0.8,解得x=-2,所以硫化钠被还原为Na2S,消耗标况下H2的体积为4.48L,物质的量为0.2mol,氢气提供的电子为0.2mol×2=0.4mol,所以有0.4mol电子是CO提供,CO被氧化为CO2,需CO为
=0.2mol,所以该反应的化学方程式为Na2SO4+2CO+2H2
Na2S+2CO2+2H2O.
故答案为:Na2SO4+2CO+2H2
Na2S+2CO2+2H2O.
故W为碳元素,Y为钠元素,X为氧元素;Z为硫元素.
(1)W为碳元素、X为氧元素,WX2是CO2,分子中碳元素与氧原子之间形成2对共用电子对,电子式为
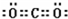 .
.故答案为:
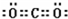 .
.(2)X为氧元素,Y为钠元素,Z为硫元素,同周期自左而右原子半径减小,所以Na>S,同主族自上而下原子半径增大,所以S>O,故原子半径Na>S>O.
故答案为:Na>S>O.
(3)Y的最高价氧化物对应水化物NaOH,通入过量的二氧化碳,生成碳酸氢钠,反应离子方程式为OH-+CO2=HCO3-;
根据溶液呈电中性可知c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+).
故答案为:OH-+CO2=HCO3-;c(HCO3-)+2c(CO32-)+c(OH-)=c(Na+)+c(H+).
(4)Na2SO4与CO、H2在高温和铁做催化剂条件下反应,0.1molNa2SO4参加反应转移0.8mol电子,硫元素被还原,令硫元素在还原产物化合价中化合价为x,则0.1×(6-x)=0.8,解得x=-2,所以硫化钠被还原为Na2S,消耗标况下H2的体积为4.48L,物质的量为0.2mol,氢气提供的电子为0.2mol×2=0.4mol,所以有0.4mol电子是CO提供,CO被氧化为CO2,需CO为
| 0.4mol |
| 2 |
| ||
| △ |
故答案为:Na2SO4+2CO+2H2
| ||
| △ |

练习册系列答案
相关题目