题目内容
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
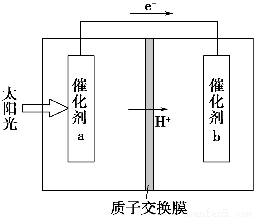
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O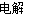 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
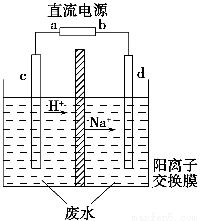
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
(1)2Cu+H2O-2e-=Cu2O+2H+ 2H++2e-=H2↑ (2)d (3)①CH4 CH4-8e++10OH-=CO32-+7H2O 不变 ②1.9
【解析】(1)由于阳极材料为铜,所以铜本身失电子被氧化,由题意知氧化产物为Cu2O,可得阳极反应式为2Cu+H2O-2e-=Cu2O+2H+,阴极上阳离子放电,即溶液中H+被还原成清洁能源H2。
(2)左半区是原电池装置,发生的是铁的吸氧腐蚀,负极(Fe):Fe-2e-=
Fe2+,正极(Cu):O2+2H2O+4e-=4OH-。右半区是电解装置,阳极(Fe):Fe-2e-=Fe2+,阴极(Cu):2H++2e-=H2↑,由于电解引起腐蚀的速率远大于吸氧腐蚀的速率,因此最先观察到变成红色的区域是④区,故选项a、b、c均错误。
(3)①根据电解液中阳离子的迁移方向,可知c为阳极,d为阴极,因此直流电源上a为正极,通入O2,b为负极,通入CH4,在碱性条件下CH4的氧化产物为CO,由此可写出此电极的电极反应式。在电解过程中,由于SO没有参与放电,且阳离子交换膜不允许阴离子自由通过,因此根据质量守恒可得阴极区Na2SO4的物质的量不变。②阴极区发生还原反应,即CH3CHO转化成CH3CH2OH,设生成的乙醇为x kg,根据碳原子守恒可得关系式:
CH3CHO ~ CH3CH2OH
44 46
3 000×103÷106×60% x
解得x≈1.9。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案