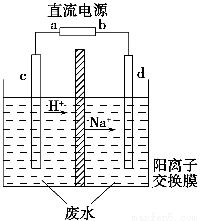
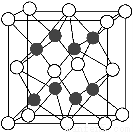
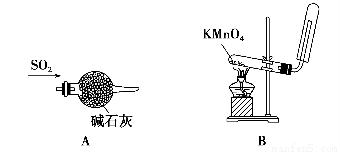
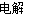题目内容
在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中K+的浓度约是(忽略溶液中少量的H+和OH-)( )。
A.0.125 mol·L-1 B.0.225 mol·L-1
C.0.250 mol·L-1 D.0.450 mol·L-1
B
【解析】设两溶液均为1 L,生成的沉淀恰好完全溶解时,发生的反应为Al3++4OH-===AlO2-+2H2O,n(AlO2-)=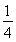 n(OH-)=
n(OH-)=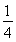 ×0.2 mol=0.05 mol,此时溶液中含有K+、AlO2-、SO42-,由电荷守恒可得关系式:n(K+)=n(AlO2-)+2n(SO42-)=0.05 mol+2×0.2 mol=0.45 mol,所以等体积混合后溶液中的c(K+)=0.225 mol·L-1。
×0.2 mol=0.05 mol,此时溶液中含有K+、AlO2-、SO42-,由电荷守恒可得关系式:n(K+)=n(AlO2-)+2n(SO42-)=0.05 mol+2×0.2 mol=0.45 mol,所以等体积混合后溶液中的c(K+)=0.225 mol·L-1。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目