题目内容
向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
| A.小于0.45摩 | B.等于0.45摩 |
| C.在0.45摩与0.90摩之间 | D.大于0.90摩 |
A
浓硫酸与铜反应的方程式为2H2SO4+Cu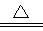 CuSO4+2H2O+SO2↑。应为只有浓硫酸才能氧化单质铜,而随着反应的不断进行,硫酸的量会逐渐减少,同时生成物还有水生成,因此硫酸的浓度会逐渐降低,当降低到一定程度是反应就停止。由题意知浓硫酸的物质的量是0.9mol,理论上被还原的硫酸的物质的量是0.45mol,但事实上被还原的硫酸的物质的量要小于0.45mol,所以答案选A。
CuSO4+2H2O+SO2↑。应为只有浓硫酸才能氧化单质铜,而随着反应的不断进行,硫酸的量会逐渐减少,同时生成物还有水生成,因此硫酸的浓度会逐渐降低,当降低到一定程度是反应就停止。由题意知浓硫酸的物质的量是0.9mol,理论上被还原的硫酸的物质的量是0.45mol,但事实上被还原的硫酸的物质的量要小于0.45mol,所以答案选A。
 CuSO4+2H2O+SO2↑。应为只有浓硫酸才能氧化单质铜,而随着反应的不断进行,硫酸的量会逐渐减少,同时生成物还有水生成,因此硫酸的浓度会逐渐降低,当降低到一定程度是反应就停止。由题意知浓硫酸的物质的量是0.9mol,理论上被还原的硫酸的物质的量是0.45mol,但事实上被还原的硫酸的物质的量要小于0.45mol,所以答案选A。
CuSO4+2H2O+SO2↑。应为只有浓硫酸才能氧化单质铜,而随着反应的不断进行,硫酸的量会逐渐减少,同时生成物还有水生成,因此硫酸的浓度会逐渐降低,当降低到一定程度是反应就停止。由题意知浓硫酸的物质的量是0.9mol,理论上被还原的硫酸的物质的量是0.45mol,但事实上被还原的硫酸的物质的量要小于0.45mol,所以答案选A。
练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目