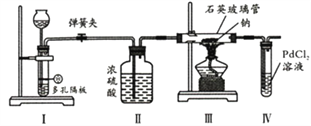
题目内容
【题目】关于sp3杂化轨道说法正确的是( )
A. 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是四面体
B. ![]() 分子中的
分子中的![]() 杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C. 金刚石是三维网状结构,由碳原子从sp3杂化轨道形成共价键
D. NH3和BF3分子中,中心原子均采用sp3杂化
【答案】C
【解析】A.凡中心原子采取sp3杂化的分子构型都是四面体形,当有孤对电子时可能呈V形或三角锥形,故A错误;B.CH4分子中的sp3杂化轨道是由中心碳原子的能量相近2s轨道和3个2p轨道杂化形成,故B错误;C.金刚石为三维网状结构,一个碳与四个碳原子形成共价键,所以碳原子以sp3杂化,故C正确;D.BF3中B原子上没有孤对电子,采用sp2杂化,故D错误;故选C。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
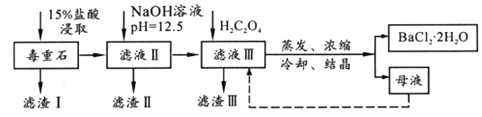
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。