题目内容
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
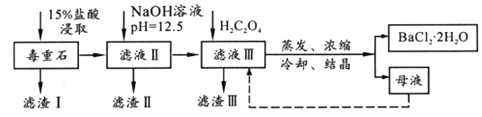
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。
【答案】 SiO2、BaSO4 玻璃棒、烧杯、漏斗 1.0×10-8mol/L 防止生成BaC2O4 Na+ 不可行 母液中的NaCl浓度会越来越大,最终产品纯度降低 CaC2O4·H2O 2CaC2O4+O2 ![]() 2CaCO3+2CO2
2CaCO3+2CO2
【解析】毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)加入盐酸溶解,生成氯化钙、氯化镁、氯化钡和氯化铁,且少量硫酸根与钡离子反应生成硫酸钡,滤渣Ⅰ为SiO2、BaSO4;加入氢氧化钠调节pH=12.5,铁离子、镁离子转化为氢氧化镁、氢氧化铁沉淀进入滤渣Ⅱ,滤液为氯化钡和氯化钙,加入草酸反应生成草酸钙沉淀,即滤渣Ⅲ为草酸钙;滤液Ⅲ蒸发浓缩、冷却结晶得到氯化钡晶体。(1)滤渣I的成分为SiO2、BaSO4,过滤所需玻璃仪器有玻璃棒、烧杯、漏斗;(2)镁离子完全沉淀的pH=11,则Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=10-5![]() (10-3)2=1.0×10-11,当pH=12.5时,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)
(10-3)2=1.0×10-11,当pH=12.5时,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)![]() (10-1.5)2=1.0×10-11,加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为1.0×10-8mol/L;加入H2C2O4时应避免过量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,过程中加入氢氧化钠,故还含有大量的Na+。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,在实际工业生产中不可行,因为母液中的NaCl浓度会越来越大,最终产品纯度降低;(4)根据上面分析可知,滤渣III的成分是CaC2O4·H2O;根据CaC2O4和CaCO3的相对分子质量分别为146、100,200~470℃时发生反应生成物为碳酸钙和二氧化碳,反应的化学方程式为2CaC2O4+O2
(10-1.5)2=1.0×10-11,加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为1.0×10-8mol/L;加入H2C2O4时应避免过量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,过程中加入氢氧化钠,故还含有大量的Na+。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,在实际工业生产中不可行,因为母液中的NaCl浓度会越来越大,最终产品纯度降低;(4)根据上面分析可知,滤渣III的成分是CaC2O4·H2O;根据CaC2O4和CaCO3的相对分子质量分别为146、100,200~470℃时发生反应生成物为碳酸钙和二氧化碳,反应的化学方程式为2CaC2O4+O2 ![]() 2CaCO3+2CO2。
2CaCO3+2CO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究性学习小组在辛集中学的玫瑰园与辛中公园附近分别采集一份土壤,分别配制成体积相同的两份营养液,其中两份各成分的含量如下:
含量 成分 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
① | 0.3mol | 0.2mol | 0.1mol | ﹣ |
② | 0.1mol | 0.3mol | ﹣ | 0.1mol |
两份营养液的成分
A. 完全不同 B. 完全相同
C. 只有n(K+)相同 D. 只有 n(Cl﹣)相同
