��Ŀ����
����Ŀ���ڲ�ͬ�¶��£���2L�ܱ������м���1molNO��1mol����̿��������Ӧ��2NO��g��+C��s���TN2��g��+CO2��g����H=��213.5kJ mol��1 �� �ﵽƽ��ʱ���������£�
�¶�/�� | n������̿��/mol | n��CO2��/mol |
T1 | 0.70 | |
T2 | 0.25 |
����˵������ȷ���ǣ� ��
A.������Ϣ����֪��T1��T2
B.T1��ʱ���÷�Ӧ��ƽ�ⳣ��K= ![]()
C.T1��ʱ������ʼʱ��Ӧ�����������Сһ�룬ƽ���NO��ת���ʼ�С
D.T2��ʱ������Ӧ��ƽ�������С�����������c��N2����c��NO������
���𰸡�C
���������⣺A���¶�T1ʱ����ƽ��ʱ�ĵ�n������̿��=1mol��0.7mol=0.3mol����ƽ��ʱ���ɵ�n��CO2��=0.3mol���¶�T2ʱ�����ɵ�n��CO2��=0.25mol��0.3mol��ƽ�������ƶ�������ӦΪ���ȷ�Ӧ������ƽ�������ƶ������¶�T1��T2 �� ��A��ȷ��
B���¶�T1ʱ������̿��ƽ�����ʵ���Ϊ0.70mol�������ĵ�n������̿��=1mol��0.7mol=0.3mol�������ĵ�n��NO��=0.6mol��ƽ��ʱn��NO��=1mol��0.6mol=0.4mol�����ɵ�n��N2��=0.3mol�����ɵ�n��CO2��=0.3mol����Ӧ��������������䣬�����ʵ�������Ũ�ȼ���ƽ�ⳣ������K= ![]() =
= ![]() =
= ![]() ����B��ȷ��
����B��ȷ��
C��T1��ʱ������ʼʱ��Ӧ�����������Сһ�룬��ЧΪ����ѹǿ����Ӧǰ������������䣬ƽ�ⲻ�ƶ���NO��ת���ʲ��䣬��C����
D��ƽ�������С�����������ѹǿ����Ӧǰ������������䣬ƽ�ⲻ�ƶ�����c ��N2����c ��NO�����䣬��D��ȷ��
��ѡ��C��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

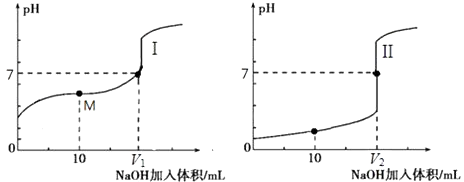
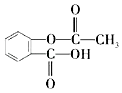
����Ŀ��ijͬѧ���к͵ζ���ȥ�ⶨij�ռ�Ĵ��ȣ�ʵ��������£�
��i�����ƴ���Һ��ȡ�� 5.0g �����ռ���Ʒ�����ʲ����ᷴӦ�����Ƴ� 250mL ��Һ��
��ii���� 0.2000molL��1 ������ζ������ռ���Һ��ʵ��������� A���ü�ʽ�ζ���ȡ�����ռ���Һ10.00mL��ע����ƿ�У�����ָʾ����B���ô��ⶨ ����Һ��ϴ��ʽ�ζ��ܣ�C��������ˮϴ�ɾ��ζ��ܣ�D��ȡ����ʽ�ζ����ñ������� ��Һ��ϴ����Һע����ʽ�ζ��̶ܿȡ�0������2��3cm�����ٰ���ʽ�ζ��̶ܹ��ã�����Һ�����̶ȡ�0����0���̶����£�E�����ζ����Ƿ�©ˮ��F����ȡ��ƿ�����ظ� ����һ�Σ�G������ƿ���ڵζ������棬�ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ��Ŀ̶ȣ�
��1���ٵζ���������ȷ˳���ǣ��������д���� ��
�ڸõζ�������Ӧѡ�õ�ָʾ���ǣ� ��
����G���������ȷ���յ㣿
��2�����ݴ���
ʵ�������� | ������Һ���V��mL�� | ����������Һ��� V��mL�� |
1 | 22.4 | 10.00 |
2 | 22.60 | 10.00 |
3 | 26.00 | 10.00 |
4 | 22.50 | 10.00 |
�������������ݣ�ѡȡ���ʵ����飬��������ռ���Һ��Ũ��Ϊ �� �ռ� �Ĵ���Ϊ
��3�����в������ᵼ��ʵ����ƫ�͵���������ţ���
�ټ�ʽ�ι�������ˮϴ����û���ô���Һ��ϴ ����ƿ������ˮϴ����û���ô���Һ��ϴ ���յ����ʱ���ӣ��ζ�ǰ����ȷ�� ����ʽ�ζ��ܼ������û���ų����ζ�����ʧ ����ʱ��ƿ��Һ�ηɽ����� ����ʽ�ζ���������ˮϴ����û���ñ�Һ��ϴ��