题目内容
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
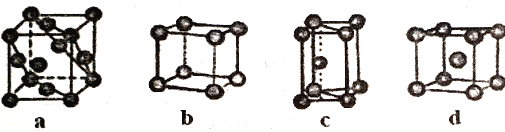
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
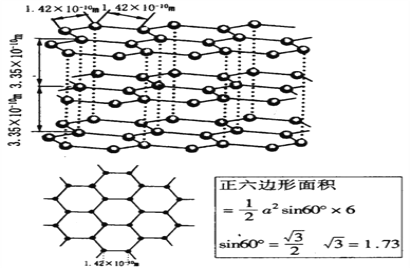
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
【答案】 3d104s24p3 109。28’ 4 sp3 CEF 分子晶体 d ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3)
【解析】(1).As的原子序数为33,基态As原子的电子排布式为[Ar]3d104s24p3,故答案为:3d104s24p3;
(2).立方氮化硼与金刚石的构型类似,金刚石为正四面体结构,键角为键角为109o 28′,则其晶胞中BNB之间的夹角是109o 28′,故答案为:109o 28′;
(3).①. 砷化硼(BAs)的晶体结构与金刚石相似,因金刚石是原子晶体,每个碳原子可形成4个碳碳单键,则每个As与可与4个B相连,As的杂化形式为sp3,故答案为:4;sp3;
②.因金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为σ键,又因为砷原子还有1对孤对电子,而B原子有容纳孤对电子的空轨道,所以还可以形成配位键,故答案为:CEF;
(4).铁的另一种配合物Fe(CO)5的熔沸点低,且易溶于CCl4,依据分子晶体熔沸点低、且存在相似相溶原理可知,Fe(CO)5晶体属于分子晶体,故答案为:分子晶体;
(5).金属钠属于体心立方堆积模型,故答案为:d;
(6).由于每个正六边形为两个正六棱柱所共有,且每个正六棱柱又有上下两个正六边形,所以每个正六棱柱拥有C原子数为2个,而一个正六棱柱的体积为:1/2×(1.42×10-10m)2×![]() ×6×3.35×10-10m=1.75×10-23cm3,则石墨的密度:ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3),故答案为:ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3)。
×6×3.35×10-10m=1.75×10-23cm3,则石墨的密度:ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3),故答案为:ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3)。

 优百分课时互动系列答案
优百分课时互动系列答案