题目内容
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____周期第_____族
(2)元素T与X相比,原子半径较大的是 ________(用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________(用元素符号表示);
下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________。
【答案】二 VIA N ![]() 2Na2O2+2H2O==4NaOH+O2↑ Na b、d N2H4+2H2O2===N2↑+4H2O
2Na2O2+2H2O==4NaOH+O2↑ Na b、d N2H4+2H2O2===N2↑+4H2O
【解析】
T元素最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以,次外层是K层,最外层是L层,K层排2个电子,L层排6个电子,所以是氧元素;
X元素常温下单质为双原子分子,分子中含有3对共用电子对知,该元素原子最外层5个电子,主族元素的族序数=其最外层电子数,所以是氮元素;
Y元素原子M层比K层少1个电子,则Y原子有3个电子层,最外层电子数为1,所以是钠元素;
Z元素是第3周期元素的简单离子中半径最小,金属阳离子电子层结构相同,随原子序数的增大离子半径减小,阴离子得电子后比金属阳离子多一个电子层,都比金属离子半径大,所以Z是Al元素。
(1)由分析可知T是氧元素,在周期表中位于第二周期第VIA族;
(2)由分析可知T是氧元素,X是氮元素,同一周期的原子随着原子序数的增大,它们的核电荷数增大,半径就越小,故原子半径较大的是N;
(3)上述元素中,由其中两种元素形成的既有离子键又有非极性共价键的物质常见的是Na2O2,该化合物的电子式为:![]() ;与水反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
;与水反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)Y、Z分别是钠、铝元素,同周期随原子序数增大金属性减弱,故金属性较强的是Na,比较金属强弱的方法有:与水或酸反应的剧烈程度,其最高价氧化物的水化物的碱性强弱,金属活动性顺序表,金属之间的相互置换等,物理性质不能比较金属性强弱,金属性强弱与失去电子难易有关、与失去电子数目(或化合价高低)多少无关,故ac错误,bd正确,故答案为:Na;bd;
(5)依题意可知T为氧X为氮,元素T和氢元素可形成一种18电子的化合物Q为H2O2,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W为N2H4,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,为N2H4+2H2O2=N2↑+4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下列操作对应的现象不符合事实的是
|
|
|
|
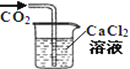
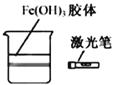
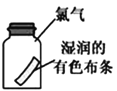
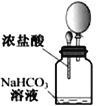
A.将二氧化碳气体通入CaCl2溶液,不会产生白色沉淀 | B.用激光笔照射Fe(OH)3胶体,产生“丁达尔效应” | C.将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色 | D.将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大 |
A. A B. B C. C D. D
【题目】“84”消毒液(有效成分为![]() )可用于消毒和漂白,下列实验现象的分析不正确的是
)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 | ①
| ② | ③
|
实验现象 | 混合后溶液的 | 混合后溶液 | 混合后溶液 |
A. 对比实验①和②,②中蓝色迅速褪去的原因是发生了反应![]()
B. 实验③中产生的气体是![]() ,由
,由![]() 分解得到:
分解得到:![]()
C. 对比实验②和③,溶液的![]() 可能会影响
可能会影响![]() 的氧化性或
的氧化性或![]() 的还原性
的还原性
D. 加酸可以提高“84”消毒液的漂白效果,但需要调控到合适的![]() 才能安全使用
才能安全使用