题目内容
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
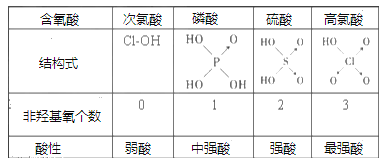
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
【答案】晶体 X-射线衍射 [Ar]3d8 分子 > 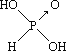 亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强 H3PO3+2NaOH=Na2HPO3+2H2O
亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强 H3PO3+2NaOH=Na2HPO3+2H2O
【解析】
根据晶体结构与性质、核外电子排布、化学键等知识分析解答;根据含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定亚磷酸(H3PO3)分子的结构式;
Ⅰ.(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,说明该互化物属于晶体,可通过X-射线衍射实验进行鉴别;
故答案为:晶体;X-射线衍射实验;
(2) Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,所以Ni2+离子核外电子排布为:1s22s22p63s23p63d8或[Ar]3d8,Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体;Ni2+和Fe2+的离子所带电荷相同,Ni2+离子半径较小,NiO中离子键更强,NiO晶体的熔点更高;
故答案为:1s22s22p63s23p63d8或[Ar]3d8,分子,>;
Ⅱ. (1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,所以亚磷酸的结构式为: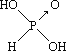 ,亚砷酸既有弱酸性又有弱碱性,亚砷酸的结构是为:
,亚砷酸既有弱酸性又有弱碱性,亚砷酸的结构是为:![]() ,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强,故亚磷酸酸性强于亚砷酸;
,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强,故亚磷酸酸性强于亚砷酸;
故答案为: ,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强;
,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强;
(2) 酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚磷酸和氢氧化钠的反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O;
故答案为:H3PO3+2NaOH=Na2HPO3+2H2O。

 冲刺100分1号卷系列答案
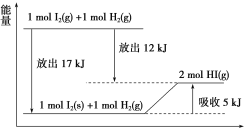
冲刺100分1号卷系列答案【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
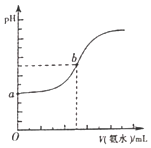
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8