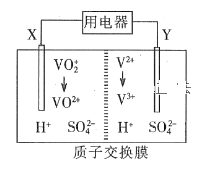
题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和 NaOH 反应的中和热 H=-57.3kJ·mol-1,则H2SO4 和 Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是 283.0kJ·mol-1 则 2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1
C.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
D.一定的温度和一定的压强下,将 0.5molN2 和1.5molH2 置于密闭容器中充分反应,放热19.3kJ,热化学方程式为 N2+3H2![]() 2NH3 ΔH=-38.6kJ·mol-1
2NH3 ΔH=-38.6kJ·mol-1
【答案】B
【解析】
A. 中和热是酸碱发生中和反应产生1mol水时放出的热量,与反应产生水的物质的量多少无关,所以H2SO4和Ba(OH)2反应的中和热ΔH=-57.3kJ/mol,A错误;
B. 燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,CO(g)的燃烧热是 283.0kJ·mol-1则2molCO燃烧放出热量是(2×283.0 )kJ,由于反应物、生成物的能量相同,所以则 2CO2(g) =2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1 ,B正确;
C. 根据体系的自由能公式△G=△H-T△S<0,反应可以自发进行,反应物的总能量低于生成物的总能量时,△H>0,若△S>0,在高温下△G<0,反应也能自发进行,C错误;
D. N2与H2合成氨气的反应是可逆反应,反应物不能完全转化为生成物,且物质的存在状态也影响物质含有的能量,所以该热化学方程式书写不合理,D错误;
故合理选项是B。

【题目】硅胶在干燥时因加有氯化钴(![]() )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成![]() 。请回答下列问题:
。请回答下列问题:
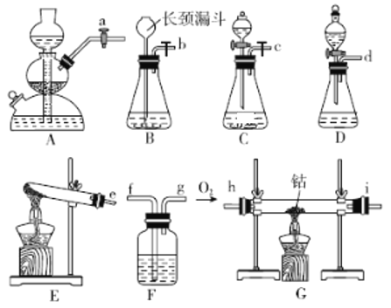
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
实验 编号 | ① | ② | ③ | ④ |
试剂 | H2O2 溶液 | H2O2 溶液 | KMnO4 固体 | H2O2溶液 |
催化剂 | MnO2粉末 | FeCl3溶液 | 以Al2O3为载体,混有MnO2的块状物 | |
装置 | ____ | ____ | ______ | ______ |
(2)第一小组负责制备无水CoO,若选用装置C作为氧气的发生装置,则制备CoO完整装置的接口连接顺序为___________,装置C发生反应的化学方程式为_______;
(3)![]() 与
与![]() 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴(![]() )形成的化合物,写出
)形成的化合物,写出![]() 与盐酸反应的化学方程式:________________。
与盐酸反应的化学方程式:________________。
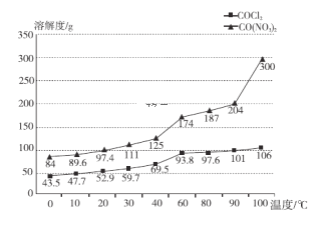
(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:__________。
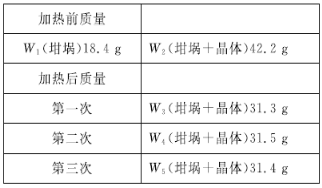
(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为________。
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D