题目内容
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
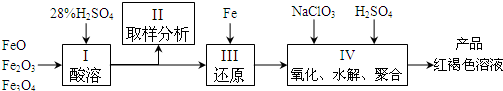
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______ Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂______.
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).

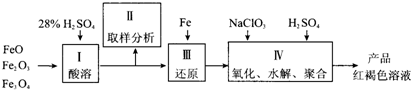
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______ Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂______.
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).
(1)配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:ab;
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量,故选:C;
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6;1;6;3H2O;
(4)因SO42?与Fe3+都采用沉淀法加以测定,根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量;故答案为:ac; BaSO4
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量,故选:C;
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6;1;6;3H2O;
(4)因SO42?与Fe3+都采用沉淀法加以测定,根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42?的物质的量;故答案为:ac; BaSO4

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

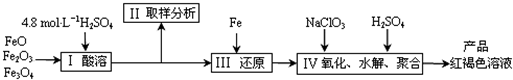
 要的用途。
要的用途。 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。 ____ 。
____ 。