题目内容
20.一氧化碳是一种用途广泛的化工基础原料.(l)在高温下CO可将SO2还原为单质硫.已知:
2CO(g)+O2(s)=2CO2(g)△H1=-566.0kJ•mol-1
S(s)+O2(g)=SO2 (g)△H2=-296.0kJ•mol-1
请写出CO还原SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(2)工业土用一氧化碳制取氢气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g)已知420℃时,该反应的化学平衡常数K=9.如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为75%,H2的平均生成速率为0.045mol•L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为吸热反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
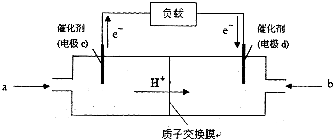
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是负极(填“正极”或“负极”),c电极的反应方程式为CH3OH-6e-+H2O=CO2+6H+.若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的d极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为11.2L.
分析 (1)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
(3)原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;
根据c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答 解:(1)①2CO(g)+O2(s)=2CO2(g)△H1=-566.0kJ•mol-1
②S(s)+O2(g)=SO2 (g)△H2=-296.0kJ•mol-1
根据盖斯定律,①-②得到2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1;
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,
所以CO的转化率α(CO)=$\frac{0.225mol/L}{0.30mol/L}$×100%=75%,
氢气反应速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol/(L•min),
其他条件不变时,升温至520℃,CO的转化率增大,说明平衡逆向进行,正反应为吸热反应;
故答案为:75%;0.045mol/(L•min);吸热;
(3)甲醇具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
因c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极d相连,
精铜电极电极反应式:Cu2++2e-=Cu,Cu2+的物质的量为=$\frac{64g}{64g/mol}$=1mol,由电子得失守恒可知电子转移2mol,
原电池中正极电极反应为4OH--4e-=2H2O+O2↑,则生成氧气物质的量为0.5mol,体积=0.5mol×22.4L/mol=11.2L;
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;d;11.2.
点评 本题考查了化学平衡常数的求算、电解质原理、原电池原理、氧化还原反应,综合性强,难度中等.

 阅读快车系列答案
阅读快车系列答案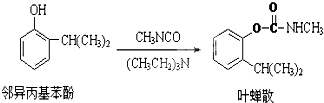
| A. | 邻异丙基苯酚发生了加成反应 | |
| B. | 邻异丙基苯酚发生了取代反应 | |
| C. | 除去叶蝉散中的邻异丙基苯酚可选用NaOH(aq) | |
| D. | 叶蝉散中是否含邻异丙基苯酚可用少量稀溴水检验 |
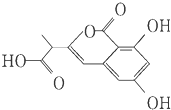
| A. | 该有机物中含一个手性碳原子 | |
| B. | 1 mol该有机物最多可以和3 mol NaOH反应 | |
| C. | 该有机物能发生水解反应 | |
| D. | 该有机物容易发生加成、取代、消去等反应 |
| A. | BaSO4和BaCO3均难溶于水,均可用作“钡餐” | |
| B. | 轮船的外壳和铁锅等生锈主要发生了电化学腐蚀 | |
| C. | 钻石和水晶都是人们熟知的宝石,但其化学成分不同 | |
| D. | 硫酸铁和明矾都可用于净水 |
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
| X | L | Z |
| Y | W |
| A. | Y的原子半径一定比L的大 | |
| B. | 若X、Y为非金属元素,则X、Y元素形成的单质晶体类型一定相同 | |
| C. | 若X、W能组成XW型分子,则其空间构型分子,则其空间构型一定为直线型 | |
| D. | 对应简单氢化物的沸点可能是X>Y、Z>W |
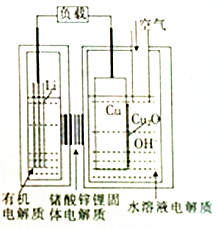 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,负极的电极反应式为Cu2O+H2O+2e-=Cu+2OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |