题目内容
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中
投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又退色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液退色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞退色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是 。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
(1)①溶液的红色退去
②在滴有酚酞的水中加入足量过氧化钠,待反应完成后向溶液中加入少量二氧化锰粉末,有气体放出,证明过氧化钠与水反应时有H2O2生成。
(2)向滴有酚酞的氢氧化钠溶液中通入氧气,若红色退去,证明甲同学的推测正确,反之,则不正确。实验装置图如图所示(可用广口瓶等其他仪器代替烧杯,合理即可)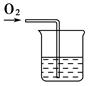
解析

 全能测控一本好卷系列答案
全能测控一本好卷系列答案日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。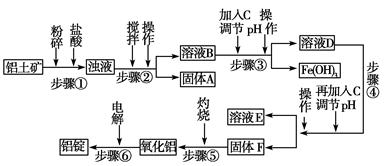
一些氢氧化物沉淀的pH如下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 |
| 沉淀的pH范围 | 1.5~4.1 | 9.4~12.4 | 3.3~5.2 |
Ⅱ.相关实验:

Ⅲ.实验数据:
①矿石样品质量为:8.22 g
②实验过程中得到固体的质量:A—2.40 g、D—2.14 g、F—1.56 g
③每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题:
(1)过滤操作需要的玻璃仪器有:_____________________________________。
(2)写出由D制一种红色颜料的化学方程式:_____________________________________。
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你根据滤液E中可能含有的成分,设计一个从滤液E制取耐火材料的实验方法:__________________________。
(4)滤液B与NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为_______________________________________________________。
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式:___________________________。