题目内容
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列判断正确的是
| A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:C1->CN- |
B
试题分析:根据方程式可知,反应中碳元素的化合价从+2升高到+4价,失去2个电子。氮元素的化合价从-3价升高到0价,失去3个电子,因此CN-是还原剂;氯元素的化合价从0价降低到-1价,得到1个电子,氯气是氧化剂。A、根据方程式可知,反应前后溶液中阴离子的个数是不变,A不正确;B、该反应中,每有2molCN-反应,转移电子为2mol×5=10mol,B正确;C、还原剂是CN-,C不正确;D、氧化还原反应中还原剂的还原性强于还原产物的还原性,所以还原性是CN->C1-,D不正确,答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
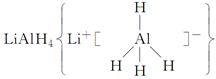 、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。
、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈反应放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法中不正确的是 ( )。