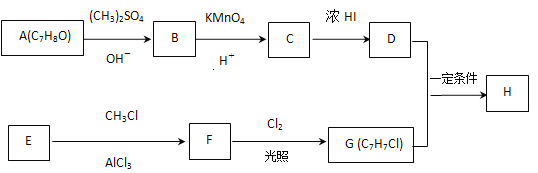
题目内容
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是

A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
【答案】D
【解析】
图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,后来平衡正向移动,气体颜色变浅,透光率增大,据此分析。
A、图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,A正确;
B、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,B正确;
C、c点平衡正向移动,气体颜色变浅,透光率增大,所以v(正)>v(逆),C正确;
D、c点以后平衡正向移动,气体颜色变浅,透光率增大,又反应放热,导致T(c)<T(d),D错误;
答案选D。

【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。