题目内容
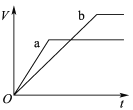
【题目】在某温度下,冰醋酸(纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
(1)起点导电能力为0的理由是__________________.
(2)用湿润的pH试纸测量a处溶液的pH,测量结果______(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)

①pH:________;
②醋酸的电离程度:_________;
③醋酸的电离平衡常数:____________;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:______.
(4)若使c点溶液中c(CH3COO﹣)增大,c(H+)减小,可采用的措施有(答二类不同的物质):①_________,②__________.
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是______.
A.c(H+) B.H+个数 C.CH3COOH个数 D.![]()
【答案】无自由移动的离子 偏小c>a>bc>b>aa=b=ca=b=c加 NaOH 加 Na2CO3、锌等BD
【解析】
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)用湿润的pH试纸测量a处溶液的pH,相对于将溶液稀释;
(3)①导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
②溶液越稀,越促进醋酸电离;
③弱电解质的电离平衡常数只受温度影响,温度不变,电离平衡常数不变;
④abc三点醋酸浓度不同,但所含醋酸的物质的量相同;
(4)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可溶性盐、加入固体碱或加入和氢离子反应的固体物质;使c(H+)减小,可以加碱或加入和氢离子反应的固体物质;
(5)加水稀释,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此解答。
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,因此,本题正确答案是:无自由移动的离子。
(2)据图可以知道将a处醋酸稀释,氢离子浓度增大,所以用湿润的pH试纸测量a处溶液的pH,测量结果偏小,因此,本题正确答案是:偏小。
(3)①导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为c>a>b,因此,本题正确答案是:c>a>b。
②溶液越稀,越促进醋酸电离,醋酸的电离度由大到小的顺序为c>b>a,因此,本题正确答案是:c>b>a。
③弱电解质的电离平衡常数只受温度影响,温度不变,电离平衡常数不变,所以abc三点的电离平衡常数相等,因此,本题正确答案是:a=b=c。
④abc三点醋酸浓度不同,但所含醋酸的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积相同,因此,本题正确答案是:a=b=c。
(4)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可溶性盐、加入固体碱或加入和氢离子反应的固体物质;使c(H+)减小,可以加碱或加入和氢离子反应的固体物质,综合考虑,可以加入NaOH、 Na2CO3、锌等;因此,本题正确答案是:加NaOH;加 Na2CO3、锌等。
(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;
B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;
C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;
D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,在同一溶液中,体积相同,则![]() =n(H+)/n(CH3COOH),比值增大,故D正确;
=n(H+)/n(CH3COOH),比值增大,故D正确;
因此,本题正确答案是:BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案