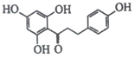
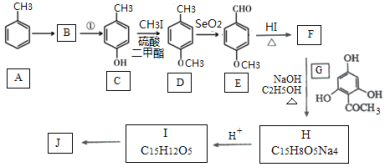
题目内容
【题目】一定温度下,将0.1molAgCl固体加入1L0.1molL-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
A.沉淀转化反应![]() 的平衡常数为20molL-1
的平衡常数为20molL-1
B.约有10-5molAgCl溶解
C.反应后溶液中的:c(Na+)>c(CO32-)>c(Cl-)>c(Ag+)>c(H+)
D.反应后溶液中的:c(Na+)+c(Ag+)=2c(CO32-)+c(HCO3-)+c(Cl-)
【答案】C
【解析】
A.根据沉淀转化反应的化学平衡常数应为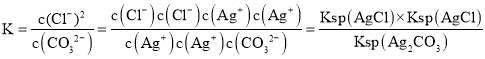 进行计算;
进行计算;
B.由于Na2CO3在溶液中完全电离,此时c(CO32-)=0.1molL-1,Ksp(Ag2CO3)= c2(Ag+) c(CO32-)=1×10-11,求出c(Ag+)后代入Ksp(AgCl)= c(Ag+)c(Cl-),可计算出c(Cl-),由此可进一步得到溶解的AgCl的量;
C.根据B项中计算出的c(Ag+)和c(Cl-)的大小关系进行比较;
D.依据溶液中电荷守恒进行分析判断。
A.因为碳酸银和氯化银沉淀都存在,二者沉淀溶解平衡,都存在,且银离子浓度相同,沉淀转化反应的化学平衡常数应为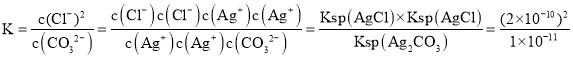 =4×10-9,A项错误;
=4×10-9,A项错误;
B. 由于Na2CO3在溶液中完全电离,此时c(CO32-)=0.1molL-1,Ksp(Ag2CO3)= c2(Ag+) c(CO32-)=1×10-11,可得c(Ag+)=1×10-5molL-1,代入Ksp(AgCl)= c(Ag+)c(Cl-),可计算出c(Cl-)=2×10-5 molL-1,由于溶解出的氯离子全部来自AgCl,因此1L溶液中约有2×10-5 molAgCl溶解,B项错误;
C.由B中计算可知,c(Ag+)=1×10-5molL-1,c(Cl-)=2×10-5 molL-1,即c(Cl-)>c(Ag+),C项正确;
D.依据溶液中电荷守恒可知,c(Na+)+c(Ag+)+c(H+)=2c(CO32-)+c(HCO3-)+c(Cl-)+c(OH-),D项错误;
答案选C。

【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1