题目内容
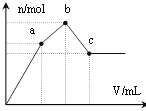
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。

下列说法中正确的是
A. 阴极反应式为4OH--4e-=2H2O+O2↑ B. 从D口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过 D. Na2SO4溶液从E口加入
【答案】C
【解析】
A.和电源负极相连的一极为电解池的阴极,得电子发生还原反应,2H++2e-=H2↑,故A错误;
B.和电源负极相连的一极为电解池的阴极,溶液中的氢离子在此极得电子,发生还原反应生成氢气,溶液中的氢氧根离子浓度增大,钠离子通过阳离子交换膜进入阴极,形成氢氧化钠溶液,所以从D口出来的是氢氧化钠溶液,故B错误;
C. 和电源负极相连的一极为电解池的阴极,溶液中的氢离子在此极得电子,发生还原反应生成氢气,溶液中的氢氧根离子浓度增大,钠离子通过阳离子交换膜进入阴极,形成氢氧化钠溶液,所以b是阳离子交换膜,允许Na+通过,故C正确;
D、NaOH在阴极附近生成,则Na2SO4溶液从G口加入,故D错误;
综上所述,本题选C。

【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] ,有关物质性质如下表所示:
物质 | 性质 |
甘氨酸(NH2CH2COOH) | 易溶于水,微溶于乙醇,两性化合物 |
柠檬酸 | 易溶于水和乙醇,有强酸性和还原性 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3 :将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe :实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)仪器E的名称是_______________。
(2)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时需要过量的试剂是______。
(3)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液,并边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________。
(4)确认C中空气排尽的实验现象是______________。
(5)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________。
(6)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_______________(填序号)。
A.热水 B.乙醇溶液 C.柠檬酸溶液
(7)若产品的质量为17.34g,则产率为________%。