题目内容
【题目】氮、硫、碳的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2△H2<0 (Ⅱ)
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应(II)达到平衡.测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1 , NO的转化率α1= . 其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag﹣ZSM﹣5为催化剂,测得NO转化为N2的转化率随温度变化的情况如图1.
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为;在 ![]() =1的条件下,应控制的最佳温度在左右.
=1的条件下,应控制的最佳温度在左右.
②NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 . 已知NO2﹣的水解常数K=2×10﹣11molL﹣1 , 常温下某NaNO2和 HNO2 混合溶液的PH为5,则混合溶液中c(NO2﹣)和c(HNO2)的比值为
(4)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 阳极的电极反应式为在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO42﹣生成.该反应的离子方程式为
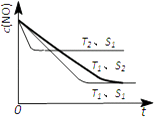
(5)消除汽车尾气,可以通过反应2NO(g)+2CO(g)2CO2(g)+N2(g).当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图3表示在其他条件不变时,NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.①该反应的△H(填“>”或“<”)0.
②若催化剂的表面积S1>S2 , 在右图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
(6)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10﹣7 , 饱和亚硫酸中c(SO32﹣)=6.3×10﹣8 molL﹣1 . 将0.1molL﹣1的BaCl2溶液滴入饱和亚硫酸中,(填“能”或“不能”)生成BaSO3沉淀,原因是(请写出必要的推断过程).
【答案】
(1)![]()
(2)75%;>
(3)NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;50
(4)SO2+2H2O﹣2e﹣=SO42﹣+4H+;4S2O42﹣+6NO2+8OH﹣═8SO42﹣+3N2+4H2O
(5)<;
(6)不能;若溶液中c(Ba2+)=0.1 mol?L﹣1 , c(SO32﹣)=6,3×10﹣8mol?L﹣1 , 其浓度积Q=c(Ba2+)×c(SO32﹣)<0.1×6.3×10﹣8=6.3×10﹣9<Ksp(BaSO3)=5.48×10﹣7
【解析】解:(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),②2NO(g)+Cl2(g)2ClNO(g),
根据盖斯定律①×2﹣②可得:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K= ![]() ,所以答案是:
,所以答案是: ![]() ;(2)测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 则△n(ClNO)=7.5×10﹣3molL﹣1min﹣1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为
;(2)测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 则△n(ClNO)=7.5×10﹣3molL﹣1min﹣1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为 ![]() ×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1 , 所以答案是:75%;>;(3)①升高温度,发现NO的分解率降低,可能是NO的分解反应是放热反应,升温有利于反应逆向进行,由图可知,在
×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1 , 所以答案是:75%;>;(3)①升高温度,发现NO的分解率降低,可能是NO的分解反应是放热反应,升温有利于反应逆向进行,由图可知,在 ![]() =1的条件下,870℃时NO还原为N2的转化率接近为100%,故最佳温度为870℃,所以答案是:NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;②常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH﹣)=10﹣9mol/L,NO2﹣的水解常数K=
=1的条件下,870℃时NO还原为N2的转化率接近为100%,故最佳温度为870℃,所以答案是:NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;②常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH﹣)=10﹣9mol/L,NO2﹣的水解常数K= ![]() =2×10﹣11molL﹣1 , 则混合溶液中c(NO2﹣)和c(HNO2)的比值为
=2×10﹣11molL﹣1 , 则混合溶液中c(NO2﹣)和c(HNO2)的比值为 ![]() =50,所以答案是:50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+;阴极排出的溶液为S2O42﹣ , 与二氧化氮发生转化为无害气体,同时有SO42﹣生成,无害气体为氮气,反应离子方程式为:4S2O42﹣+6NO2+8OH﹣═8SO42﹣+3N2+4H2O,所以答案是:SO2+2H2O﹣2e﹣=SO42﹣+4H+;4S2O42﹣+6NO2+8OH﹣═8SO42﹣+3N2+4H2O;(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1 , 温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,所以答案是:<;
=50,所以答案是:50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+;阴极排出的溶液为S2O42﹣ , 与二氧化氮发生转化为无害气体,同时有SO42﹣生成,无害气体为氮气,反应离子方程式为:4S2O42﹣+6NO2+8OH﹣═8SO42﹣+3N2+4H2O,所以答案是:SO2+2H2O﹣2e﹣=SO42﹣+4H+;4S2O42﹣+6NO2+8OH﹣═8SO42﹣+3N2+4H2O;(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1 , 温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,所以答案是:<;
②.催化剂的表面积S1>S2 , 则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: 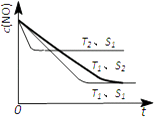 ,所以答案是:
,所以答案是:  ;(6)若溶液中c(Ba2+)=0.1 molL﹣1 , c(SO32﹣)=6.3×10﹣8molL﹣1 , 其浓度积Q=c(Ba2+)×c(SO32﹣)=0.1×6.3×10﹣8=6.3×10﹣9<Ksp(BaSO3)=5.48×10﹣7 , 故不能析出BaSO3沉淀,
;(6)若溶液中c(Ba2+)=0.1 molL﹣1 , c(SO32﹣)=6.3×10﹣8molL﹣1 , 其浓度积Q=c(Ba2+)×c(SO32﹣)=0.1×6.3×10﹣8=6.3×10﹣9<Ksp(BaSO3)=5.48×10﹣7 , 故不能析出BaSO3沉淀,
所以答案是:不能;若溶液中c(Ba2+)=0.1 molL﹣1 , c(SO32﹣)=6,3×10﹣8molL﹣1 , 其浓度积Q=c(Ba2+)×c(SO32﹣)<01×6.3×10﹣8=6.3×10﹣9<Ksp(BaSO3)=5.48×10﹣7 .
【考点精析】本题主要考查了化学平衡常数的含义和化学平衡状态本质及特征的相关知识点,需要掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案