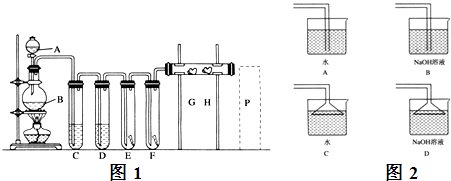
题目内容
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分.E原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E+离子的最外层电子排布式 , A、B、C的第一电离能最小的是
(2)A的最高价含氧酸分子中心原子是杂化.
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为 , 一个B原子周围距离最近且等距的B原子有个.B原子的堆积方式与下图中的相同.(填“图二”或“图三”)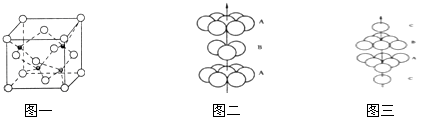
(4)1183K以下D晶体的晶胞为钾型,而1183K以上则转变为铜型,在两种晶胞中最邻近的D原子间距离相同,则两种晶体中原子的空间利用率之比为(可用根号表示).
(5)开发新型储氢材料是氢能利用的重要研究方向.分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是(填标号).
A.H2O
B.CH4
C.HF
D.CO(NH2)2 .
【答案】
(1)3s23p63d10;Al
(2)sp2
(3)AlN;12;图三
(4)![]()
(5)BC
【解析】解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,B元素是地壳中含量最多的金属元素,则B是Al元素;A原子核外有三个未成对电子,A为第VA族元素,A原子序数小于B,则A是N元素;C原子核外的M层中有两对成对电子,则C是Si元素;D是使用最广泛的合金的主要成分,则D是Fe元素;E原子核外最外层只有1个电子,其余各层电子均充满,则E是Cu元素;(1)E是Cu元素,其原子核外有29个电子,失去一个电子生成亚铜离子,M层为最外层,3s、3p、3d能级分别有2、6、10个电子,亚铜离子最外层电子排布式为3s23p63d10;A、B、C分别是N、Al、Si元素,元素的金属性越强,其第一电离能越小,这三种元素中金属性最强的是Al,所以第一电离能最小的是Al;所以答案是:3s23p63d10;Al;(2)A的最高价含氧酸是HNO3 , N原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论值N原子杂化方式为sp2 , 所以答案是:sp2;(3)该晶胞中,铝离子个数=8× ![]() +6×
+6× ![]() =4,氧离子个数=4,铝离子和氧离子个数之比=4:4=1:1,所以化学式为AlN;一个Al离子周围距离最近的Al离子个数=3×8×
=4,氧离子个数=4,铝离子和氧离子个数之比=4:4=1:1,所以化学式为AlN;一个Al离子周围距离最近的Al离子个数=3×8× ![]() =12;B晶胞是面心立方最密堆积,所以为图三,所以答案是:AlN;12;图三;(4)钾型晶胞中Fe原子个数=1+8×
=12;B晶胞是面心立方最密堆积,所以为图三,所以答案是:AlN;12;图三;(4)钾型晶胞中Fe原子个数=1+8× ![]() =2,设Fe原子半径为x,晶胞棱长=
=2,设Fe原子半径为x,晶胞棱长= ![]() ,晶胞体积=(
,晶胞体积=( ![]() )3 , 铁原子总体积=
)3 , 铁原子总体积= ![]() ,空间利用率=
,空间利用率= ![]() ; Cu型晶胞中铁原子个数=8×
; Cu型晶胞中铁原子个数=8× ![]() +6×
+6× ![]() =4,铁原子总体积=
=4,铁原子总体积= ![]() ,晶胞棱长=
,晶胞棱长= ![]() ,晶胞体积=(
,晶胞体积=( ![]() )3 , 空间利用率=
)3 , 空间利用率= ![]() ,则钾型与铜型原子利用率之比=
,则钾型与铜型原子利用率之比= ![]() :
: ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;(5)CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,故选BC.
;(5)CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,故选BC.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】相同体积的某营养液两份,其配方如下表:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
(1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
(2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
比较两份营养液中各种离子的浓度,下列有关说法正确的是( )
A.各种离子的浓度均相同
B.只有c(K+)相同
C.各种离子的浓度均不同
D.只有c(Zn2+)相同