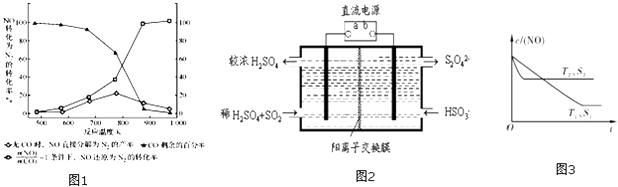
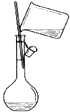
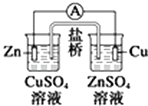
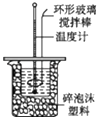
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,22.4 L苯中含有的分子数目为NA
B. 25℃、101 kPa时,20 g SO3中含有的原子数目为NA
C. 1 mol·L-1 MgCl2溶液中含有的氯离子数目为2NA
D. 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA
【答案】B
【解析】A、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,A项错误;B、20 g SO3的物质的量=![]() =0.25 mol,所含原子数0.25mol
=0.25 mol,所含原子数0.25mol![]() 4
4![]() NA=NA,B项正确;C、氯离子的浓度为2 mol·L-1,未给体积,无法求算氯离子数目,C项错误;D、16.8 g铁的物质的量=
NA=NA,B项正确;C、氯离子的浓度为2 mol·L-1,未给体积,无法求算氯离子数目,C项错误;D、16.8 g铁的物质的量=![]() =0.3 mol而铁和水蒸气反应后变为+
=0.3 mol而铁和水蒸气反应后变为+![]() 价,故0.3 mol铁转移0.8 NA个电子,D项错误;答案选B。
价,故0.3 mol铁转移0.8 NA个电子,D项错误;答案选B。

练习册系列答案
相关题目
【题目】相同体积的某营养液两份,其配方如下表:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
(1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
(2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
比较两份营养液中各种离子的浓度,下列有关说法正确的是( )
A.各种离子的浓度均相同
B.只有c(K+)相同
C.各种离子的浓度均不同
D.只有c(Zn2+)相同