题目内容
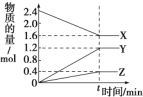
【题目】某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响,烧杯中都盛有稀H2SO4。试回答:
(1)B装置中Fe电极作为________(填“正”或“负”)极,电极反应式为______________;
(2)C装置中阳离子移向_________(填“Zn”或“Fe”)极;
(3)比较四个装置中Fe片被腐蚀的速率由快到慢的顺序是_______(用A、B、C、D表示)。

【答案】负 Fe-2e-=Fe2+ Fe DBAC
【解析】
本题考查原电池原理的应用以及腐蚀速率快慢的比较等知识。
(1)原电池中活泼金属做负极,失电子,发生氧化反应;
(2)溶液中的阳离子移向正极;
(3)同一个金属腐蚀由快到慢的顺序为:电解原理引起的腐蚀![]() 原电池原理引起的腐蚀
原电池原理引起的腐蚀![]() 化学腐蚀
化学腐蚀![]() 有防护措施的腐蚀,据此来分析腐蚀速率的快慢。
有防护措施的腐蚀,据此来分析腐蚀速率的快慢。
(1)B装置为原电池,Fe电极发生氧化反应,为负极;电极反应式为Fe-2e-=Fe2+
(2)C装置为原电池,Zn比Fe活泼,Zn为负极,Fe为正极,阳离子移向正极,即阳离子移向Fe极;
(3)A发生化学腐蚀;B中Fe发生电化学腐蚀;C锌比铁活泼,铁做原电池的正极而被保护;D中铁作电解池阳极被腐蚀速率最快,且电化学腐蚀的速率大于化学腐蚀的速率,故答案为:DBAC。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】化学平衡状态Ⅰ、Ⅱ、III的相关数据如下表:
编号 | 化学方程式 | 平衡常数 | 温度 | |
979K | 1173K | |||
Ⅰ | Fe(s)+CO2(g) FeO(s)+ CO(g) | K1 | 1.47 | 2.15 |
Ⅱ | CO(g)+H2O(g) CO2(g)+H2(g) | K2 | 1.62 | b |
Ⅲ | Fe(s)+ H2O(g) FeO(s) +H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论正确的是
A.a<b
B.反应Ⅱ、III均为放热反应
C.升高温度平衡状态III向正反应方向移动
D.增大压强,状态Ⅱ正反应速率增大,逆反应速率减小,平衡不移动
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。