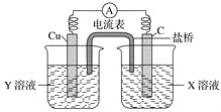
题目内容
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )
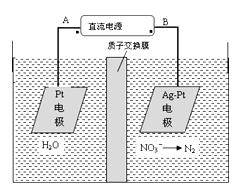
A. 电解过程中,每转移1mol电子,则左侧电极就产生16g O2
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. B为电源的负极
【答案】A
【解析】
该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极,pt电极为阳极,连接阴极的B电极为负极,A为正极。
A.左侧电极为阳极发生2H2O-4e-=4H++O2![]() ,所以每转移1 mol电子时,左侧电极就产生0.25 mol O2即8g氧气,故A项错误;B.电解时阳离子向阴极移动,所以H+从阳极向阴极迁移,故B项正确;C.阴极上硝酸根离子得电子发生还原反应,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故C项正确; D. B为电源的负极,故D正确;答案:A。
,所以每转移1 mol电子时,左侧电极就产生0.25 mol O2即8g氧气,故A项错误;B.电解时阳离子向阴极移动,所以H+从阳极向阴极迁移,故B项正确;C.阴极上硝酸根离子得电子发生还原反应,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故C项正确; D. B为电源的负极,故D正确;答案:A。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。