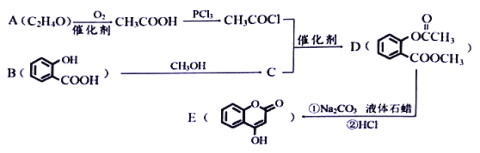
题目内容
【题目】国内最新研究,实现CO2的固定和储能的多功能电化学反应装置,如图所示。该装置充放电过程并不完全可逆,即充电过程C不参与反应。放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,下列叙述正确的是
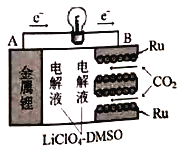
A. 放电过程正极反应式为4Li++3CO2+4e-=2Li2CO3+C
B. 若放电过程转移电子物质的量为0.2mol,理论上可以固定C的质量为1.2g
C. 充电过程B电极为阴极,发生氧化反应
D. 可用 LiClO4水溶液代替LiClO4-DMSO
【答案】A
【解析】
A. 放电过程为原电池,根据放电过程反应方程式为:4Li+3CO2=2Li2CO3+C,正极上二氧化碳得到电子生成Li2CO3和C,电极反应式为4Li++3CO2+4e-=2Li2CO3+C,故A正确;
B. 根据A的分析,若放电过程转移电子物质的量为0.2mol,理论上可以固定C0.05mol,质量为0.05mol ×12g/mol=0.6g,故B错误;
C. 放电过程中金属锂为负极,则充电过程锂电极(A)为阴极,发生还原反应,故C错误;
D. 锂能够与水反应,不能用 LiClO4水溶液代替LiClO4-DMSO,故D错误;
答案选A。

【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是![]() ,还含有少量Fe、Al、Ca、Mg等元素;
,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子![]() 形成氯氧化物沉淀时的pH如下:
形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下, ![]() 的溶度积分别为
的溶度积分别为![]()
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为_____________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:

焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入![]() 氧化为
氧化为![]() ,反应的离子方程式为________;然后调节溶液pH使
,反应的离子方程式为________;然后调节溶液pH使![]() 沉淀完全,此时溶液的pH范围为____。再加入
沉淀完全,此时溶液的pH范围为____。再加入![]() 沉淀
沉淀![]() ,当
,当![]() 时,
时, ![]() =______
=______![]()
(4)碳化结晶时,发生反应的离子方程式为___________。
(5)流程中能循环利用的固态物质是____________。