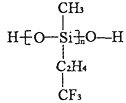
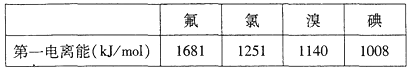
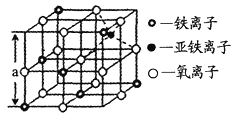
题目内容
【题目】已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01molL-1 CH3COOH溶液中逐滴加入0.01molL-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是
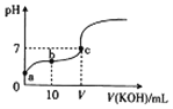
A. a点溶液中c(H+)为4.0×10-5mol/L
B. c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-)
C. V=20
D. a、b、c三点中水的电离程度最大的是c点
【答案】D
【解析】
根据平衡常数计算 c(H+);根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-);若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK;a、b点溶液呈酸性,抑制了水的电离,c点溶液呈中性,基本不影响水的电离。
设a点溶液中c(H+)=xmol/L,则![]() ,x=4.0×10-4mol/L,故A错误;根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-),所以c(K+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK,此时溶液呈碱性,c点溶液呈中性,所以V<20,故C错误;根据图象可知,a、c溶液呈酸性,氢离子抑制了水的电离,水电离的c(H+)<1×10-7mol/L,而c点溶液的pH=7,呈中性,水电离的氢离子浓度为1×10-7mol/L,所以a、b、c三点中水的电离程度最大的是c点,故D正确。
,x=4.0×10-4mol/L,故A错误;根据电荷守恒c点溶液中 c(K+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7,说明c(H+)=c(OH-),所以c(K+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;若V=20,则醋酸与 KOH恰好完全反应,溶质为CH3COOK,此时溶液呈碱性,c点溶液呈中性,所以V<20,故C错误;根据图象可知,a、c溶液呈酸性,氢离子抑制了水的电离,水电离的c(H+)<1×10-7mol/L,而c点溶液的pH=7,呈中性,水电离的氢离子浓度为1×10-7mol/L,所以a、b、c三点中水的电离程度最大的是c点,故D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目