题目内容
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为______________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
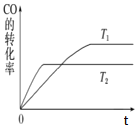
①T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
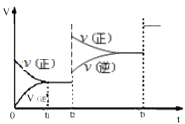
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是_____;
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(小数点后保留2位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。请写出负极的电极反应为_______________。
【答案】C(s)+H2O(g)=CO(g)+H2(g) H=+131.6 kJ/mol 高温 > c 加压 66.67 CH3OH-6e-+8OH- = CO32-+6H2O
【解析】
(1)焦炭制水煤气时,发生反应为C(s)+H2O(g)=CO(g)+H2(g)。1.2 g 碳为0.1mol,与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。由此可写出该反应的热化学方程式;该反应的H>0,由此可确定该反应能自发进行的温度。
(2)①从达平衡所用的时间可确定T1<T2,温度低时CO的转化率大,则表明正反应为放热反应,由此可得出T1和T2温度下的平衡常数大小关系。
②a.降低温度 ,平衡正向移动;
b.将CH3OH(g)从体系中分离,平衡正向移动;
c.使用合适的催化剂 ,加快反应速率,但平衡不发生移动。
③从增大压强、升高温度两方面进行分析,确定图中t2时采取的可能措施。
④假设T1℃时,CO和H2的物质的量都为1mol,参加反应CO的物质的量为x,建立三段式,然后利用“容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP。
(3)甲醇(CH3OH)燃料电池(以KOH溶液为电解质溶液)中,在两极区分别加入CH3OH和O2即可产生电流,则负极加入CH3OH,放电后生成CO32-和水,由此可写出电极反应式。
(1)焦炭制水煤气时,发生反应为C(s)+H2O(g)=CO(g)+H2(g)。1.2 g 碳为0.1mol,与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量,该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) H=+131.6 kJ/mol;该反应的H>0,该反应在高温条件下能自发进行。答案为:C(s)+H2O(g)=CO(g)+H2(g) H=+131.6 kJ/mol;高温;
(2)①从达平衡所用的时间可确定T1<T2,温度低时CO的转化率大,则表明正反应为放热反应,T1和T2温度下的平衡常数大小关系是K1>K2。答案为:>;
②a.降低温度 ,平衡正向移动,CO转化率增大,a符合题意;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大,b符合题意;
c.使用合适的催化剂 ,加快反应速率,但平衡不发生移动,c不合题意;
故选c。答案为:c;
③从图中可以看出,改变条件后,v正、v逆都增大,且平衡正向移动,若为升高温度,则平衡逆向移动,所以应为加压。答案为:加压;
④假设CO和H2的物质的量都为1mol,参加反应CO的物质的量为x,建立三段式:

依题意得:![]() ,x=0.4mol,生成甲醇的压强平衡常数KP=
,x=0.4mol,生成甲醇的压强平衡常数KP=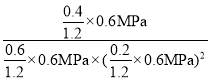 ≈66.67(MPa)-2。答案为:66.67;
≈66.67(MPa)-2。答案为:66.67;
(3)甲醇(CH3OH)燃料电池(以KOH溶液为电解质溶液)中,负极加入CH3OH,放电后生成CO32-和水,则负极反应式为CH3OH-6e-+8OH- = CO32-+6H2O。答案为:CH3OH-6e-+8OH- = CO32-+6H2O。