题目内容
19.某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)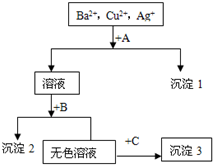
(1)沉淀的化学式:沉淀1AgCl,沉淀2Cu(OH)2,沉淀3BaSO4;
(2).写出混合液+A的离子方程式Ag++Cl-=AgCl↓,沉淀2与盐酸反应的离子方程式Cu(OH)2+2H+=Cu2++H2O.
分析 溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,根据物质的性质书写反应的离子方程式.
解答 解:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,所以沉淀1是氯化银,沉淀2是氢氧化铜,沉淀3是硫酸钡,故答案为:AgCl;Cu(OH)2;BaSO4;
(2)混合液+A反应的离子方程式为Ag++Cl-=AgCl↓,沉淀2为Cu(OH)2,与盐酸反应的离子方程式为:Cu(OH)2+2H+=Cu2++H2O,
故答案为:Ag++Cl-=AgCl↓;Cu(OH)2+2H+=Cu2++H2O.
点评 本题考查物质的分离提纯,侧重于学生的分析、实验能力的考查,涉及离子方程式的书写,题目难度中等,注意使离子逐一沉淀应先加入HCl,不能先加入NaOH,否则不能达到逐一沉淀的目的.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 某化合物不是离子化合物就是共价化合物 | |
| B. | 混合物中元素一定呈化合态 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
7.为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
( )
| 实验目的 | 主要仪器 | 试剂 | |
| A | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| B | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| C | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| D | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
14.试回答下列各题:
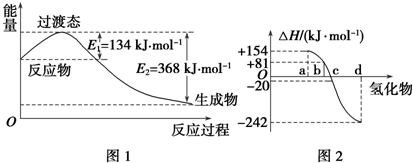
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)═Se(s)+H2(g)△H=-81 kJ•mol-1.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11 kJ•mol-1.

(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11 kJ•mol-1.
4.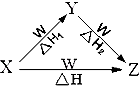 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( )
①C、CO
②AlCl3、Al(OH)3
③Fe、Fe(NO3)2
④Na2CO3、NaHCO3.
 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( ) ①C、CO
②AlCl3、Al(OH)3
③Fe、Fe(NO3)2
④Na2CO3、NaHCO3.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
11.酸雨是指pH<5.6的雨、雪等各种形式的大气降水.二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成.酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的.某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定.
第一组:取刚降到地面的酸雨水样,进行了如下实验:
实验①:将一片红色的玫瑰花瓣浸在一份水样中;
实验②:向雨水试样中滴加氯化钡溶液,有白色浑浊出现;
实验③:每隔一定时间测定其pH,数据如表Ⅰ所示.
表Ⅰ不同时间酸雨的pH
(1)实验①中一段时间后,观察到红色变浅,可能的原因是酸雨中SO2具有漂白作用.
(2)实验②中生成白色浑浊的离子方程式SO42-+Ba2+=BaSO4↓.
(3)分析实验③中pH数据的变化,你认为可能的原因是(用化学方程式表示):SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4.
(4)如果取该雨水和蒸馏水混合,再测pH,结果将变大(填“变大”“变小”或“不变”).
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
该反应的现象是高锰酸钾溶液紫色褪去,SO2在该反应中显还原(填“氧化”或“还原”)性.
(6)该实验中已知的数据有气体流速aL/min、酸性KMnO4溶液的体积bL,其浓度为cmol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为$\frac{32bc}{a}$g/L.
第一组:取刚降到地面的酸雨水样,进行了如下实验:
实验①:将一片红色的玫瑰花瓣浸在一份水样中;
实验②:向雨水试样中滴加氯化钡溶液,有白色浑浊出现;
实验③:每隔一定时间测定其pH,数据如表Ⅰ所示.
表Ⅰ不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(2)实验②中生成白色浑浊的离子方程式SO42-+Ba2+=BaSO4↓.
(3)分析实验③中pH数据的变化,你认为可能的原因是(用化学方程式表示):SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4.
(4)如果取该雨水和蒸馏水混合,再测pH,结果将变大(填“变大”“变小”或“不变”).
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
该反应的现象是高锰酸钾溶液紫色褪去,SO2在该反应中显还原(填“氧化”或“还原”)性.
(6)该实验中已知的数据有气体流速aL/min、酸性KMnO4溶液的体积bL,其浓度为cmol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为$\frac{32bc}{a}$g/L.
8.有一份气体样品的质量是14.2g,体积是4.48L(标准状况下),该气体的摩尔质量是( )
| A. | 28.4 g | B. | 28.4 mol | C. | 71 L | D. | 71 g/mol |