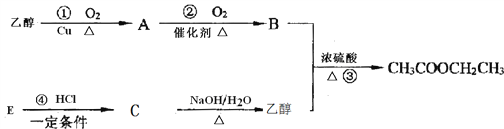
题目内容
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
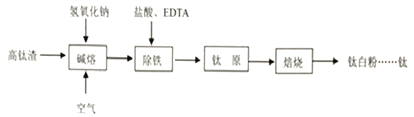
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
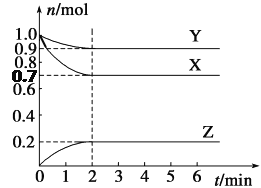
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

【答案】 TiO2+2NaOH![]() Na2TiO3+H2O 2Ti3O5+12NaOH+O2
Na2TiO3+H2O 2Ti3O5+12NaOH+O2![]() 6Na2TiO3+6H2O 5 Fe3+溶出率高,Ti4+溶出率低,节约成本。 检验沉淀是否洗涤干净 BaCl2溶液 93.4% C+2O2--4e-=CO2↑ 不变
6Na2TiO3+6H2O 5 Fe3+溶出率高,Ti4+溶出率低,节约成本。 检验沉淀是否洗涤干净 BaCl2溶液 93.4% C+2O2--4e-=CO2↑ 不变
【解析】(1)TiO2为两性氧化物,则碱熔步骤所发生反应的化学方程式为TiO2+2NaOH![]() Na2TiO3+H2O。Ti3O5中Ti元素化合价不是最高价,在反应过程中被氧气氧化,因此另一个方程式为2Ti3O5+12NaOH+O2
Na2TiO3+H2O。Ti3O5中Ti元素化合价不是最高价,在反应过程中被氧气氧化,因此另一个方程式为2Ti3O5+12NaOH+O2![]() 6Na2TiO3+6H2O。(2)根据图像可知EDTA的加入量为5时Fe3+溶出率高,Ti4+溶出率低,有利于节约成本。(3)沉淀表面有吸附的硫酸根离子,所以洗涤后需要检验沉淀是否洗涤干净,则步骤③的实验目的是检验沉淀是否洗涤干净,需要用到的试剂有BaCl2溶液。(4)消耗NH4Fe(SO4)2的物质的量是0.002336mol,根据原子守恒可知钛(Ⅲ)的物质的量也是0.002336mol,因此钛白粉的纯度为
6Na2TiO3+6H2O。(2)根据图像可知EDTA的加入量为5时Fe3+溶出率高,Ti4+溶出率低,有利于节约成本。(3)沉淀表面有吸附的硫酸根离子,所以洗涤后需要检验沉淀是否洗涤干净,则步骤③的实验目的是检验沉淀是否洗涤干净,需要用到的试剂有BaCl2溶液。(4)消耗NH4Fe(SO4)2的物质的量是0.002336mol,根据原子守恒可知钛(Ⅲ)的物质的量也是0.002336mol,因此钛白粉的纯度为![]() ×100%=93.4%。(5) 最新研究发现也可以用图示装置由TiO2获得金属钛。
×100%=93.4%。(5) 最新研究发现也可以用图示装置由TiO2获得金属钛。
根据装置图可知阳极是碳发生失去电子的氧化反应,电极反应方程式为C+2O2--4e-=CO2↑,阴极是二氧化钛得到电子,总反应式为C+TiO2=Ti+CO2↑,所以在制备金属钛前后,整套装置中CaO的总量不变。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案