题目内容
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
C
解析

中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是( )
| A.1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液 |
| B.1mol/L的稀H2SO4溶液与1mol/L的稀Ba(OH)2溶液 |
| C.1 L 1mol/L的稀HCl溶液与2 L 1mol/L的稀NaOH溶液 |
| D.1 L 1mol/L的稀H2SO4溶液与1 L 1mol/L的稀Ba(OH)2溶液 |
已知①2C(s)+O2(g) 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )
| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 | C.-352.3 kJ·mol-1 | D.+262.6 kJ·mol-1 |
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
| A.90% | B.80% | C.50% | D.40% |
反应A(g)+B(g)―→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1;②X(g)―→C(g) ΔH2。反应过程中能量变化如图1所示,E1表示A+B―→X的活化能,下列说法正确的是( )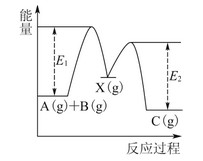
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |
对于反应:C2H4(g)=C2H2(g)+H2(g),2CH4(g)=C2H4(g)+2H2(g),当升高温度时都向右移动。①C(s)+2H2(g)=CH4(g) ΔH1;②2C(s)+H2(g)=C2H2(g)ΔH2;③2C(s)+2H2(g)=C2H4(g) ΔH3。则①②③中ΔH1、ΔH2、ΔH3的大小顺序排列正确的是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 | C.ΔH2>ΔH1>ΔH3 | D.ΔH3>ΔH2>ΔH1 |
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)ΔH=-a kJ·mol-1, ②2H2(g)+O2(g)=2H2O(l)ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1, |
则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,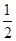 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=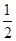 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
| A.上述热化学方程式中的化学计量数表示分子个数 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |