题目内容
反应A(g)+B(g)―→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1;②X(g)―→C(g) ΔH2。反应过程中能量变化如图1所示,E1表示A+B―→X的活化能,下列说法正确的是( )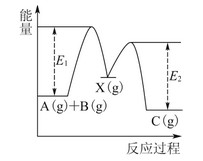
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
A
解析

练习册系列答案
相关题目
已知断开1mol H—H键吸收的能量为436kJ,形成1mol H—N键放出的能量为391kJ,根据化学方程式N2+3H2 2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )
2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )
| A.431kJ | B.945.6kJ | C.649kJ | D.869kJ |
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
 |  |  |  |
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
下列表示物质变化的化学用语中,正确的是( )
A.碱性氢氧燃料电池的负极反应式为O2+2H2O+4e- 4OH- 4OH- |
B.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e- Cl2↑ Cl2↑ |
C.表示乙炔燃烧热的热化学方程式:C2H2(g)+ O2(g) O2(g) 2CO2(g)+H2O(g) ΔH="-1" 256 kJ/mol 2CO2(g)+H2O(g) ΔH="-1" 256 kJ/mol |
D.M与N互为同素异形体,由M NΔH="+119" kJ/mol可知,N比M稳定 NΔH="+119" kJ/mol可知,N比M稳定 |
化学与社会、环境等密切相关。下列说法错误的是( )
| A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式 |
| B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放 |
| C.所有垃圾都可以采用露天焚烧或深埋的方法处理 |
| D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
已知25 ℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态溴化氢放出能量Q kJ,则下列热化学方程式书写正确的是 ( )。
| A.H2(g)+Br2(g)=2HBr(g) ΔH=-2Q kJ·mol-1 |
| B.H2(g)+Br2(l)=2HBr(g) ΔH=-Q kJ·mol-1 |
C.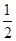 H2(g)+ H2(g)+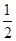 Br2(g)=HBr(g)ΔH=+ Br2(g)=HBr(g)ΔH=+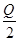 kJ·mol-1 kJ·mol-1 |
D.HBr(g)=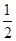 H2(g)+ H2(g)+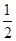 Br2(g)ΔH=+ Br2(g)ΔH=+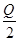 kJ·mol-1 kJ·mol-1 |
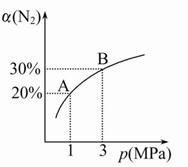
 2NH3(g)ΔH="-92.4" kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g)ΔH="-92.4" kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )