题目内容
向100 mL FeBr2溶液中通入标准状况下的Cl2 3.36 L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是多少?
c(FeBr2)=2 mol·L-1
解析:
解此题时注意两个问题:一是还原性Fe2+>Br-,故通入的Cl2首先氧化Fe2+,待Fe2+全部被氧化后才氧化Br-。二是氧化还原反应中电子转移守恒,即Fe2+、Br??所得电子数等于Cl2失去的电子数,n(Cl2)=0.15 mol,共失电子0.15 mol×2=0.3 mol。
若设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,由此可得关系式,x×1+[2x-0.15×2]×1=0.3 mol,得x=0.2 mol
c(FeBr2)= ![]() =2 mol·L-1。
=2 mol·L-1。

练习册系列答案
相关题目
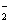 +2H2O
+2H2O B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值
B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值