题目内容
13.钠、氢、氧、硫四种元素,试关于它们填写下列空白:(1)用其中的一种或几种元素写出符合下列要求的化学式:(只需写出一种)
单质Na,酸性氧化物SO2,碱性氧化物Na2O,酸H2SO4;,碱NaOH,盐Na2SO4
(2)写出上述物质间相互反应的化学方程式:
单质与酸2Na+H2SO4=Na2SO4+H2↑
酸与碱性氧化物Na2O+H2SO4=Na2SO4+H2O
碱与酸性氧化物SO2+2NaOH=Na2SO3+H2O
单质与单质4Na+O2=2Na2O.
分析 (1)单质是指同种元素形成的纯净物;
酸性氧化物是和碱反应生成盐和水的氧化物;
碱性氧化物是和酸反应生成盐和水的氧化物;
酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指电离时生成金属阳离子或是铵根离子和酸根离子的化合物;
根据以上概念写出有关物质的化学式;
(2)根据(1)中的物质分类书写化学方程式.
解答 解:(1)钠、氢、氧、硫四种元素都可以形成自己的单质:Na、H2、O2、S;
氧化物有:Na2O、SO2、H2O等;
酸性氧化物:SO2;
碱性氧化物:Na2O;
根据酸的概念属于酸的有:H2SO4、H2SO3;
属于碱的是:NaOH;
属于盐的是:Na2SO4、Na2SO3 ;
故答案为:Na;SO2;Na2O;H2SO4;NaOH;Na2SO4 ;
(2)单质与酸2Na+H2SO4=Na2SO4+H2↑酸与碱性氧化物Na2O+H2SO4=Na2SO4+H2O碱与酸性氧化物SO2+2NaOH=Na2SO3+H2O单质与单质4Na+O2=2Na2O,
故答案为:2Na+H2SO4=Na2SO4+H2↑;Na2O+H2SO4=Na2SO4+H2O;SO2+2NaOH=Na2SO3+H2O;4Na+O2=2Na2O.
点评 本题考查物质的推断、化学方程式书写等,明确发生的化学反应是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
3.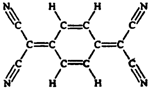 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )
 目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一.TCNQ的分子结构如图所示.下列关于TCNQ说法错误的是( )| A. | 该物质化学性质活泼,易氧化易加成 | |
| B. | 该分子不是平面分子,不可能所有原子共面 | |
| C. | 分子式为C12H4N4 | |
| D. | 该物质难溶于水 |
4.过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数如表.
合成过氧化尿素的流程及反应器的示意图如下
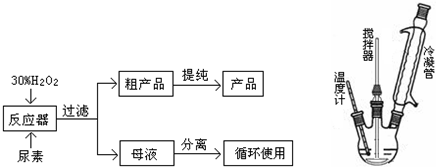
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g•L-1 |

请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
8.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 原子半径由小到大的顺序为Y<Z<X<W | |
| B. | X的简单氢化物的热稳定性比W的强 | |
| C. | 化合物YX、ZX2、WX3,中化学键的类型相同 | |
| D. | W的最高价氧化物对应水化物的酸性比Z的弱 |
18.反应N2+O2=2NO 在密闭容器中进行,下列条件哪些能增大该反应的速率(假定温度不变)( )
| A. | 缩小容器体积,使压强增大 | B. | 压强不变,充入N2 | ||
| C. | 体积不变,充入He使压强增大 | D. | 减小压强,使容器体积增大 |
5.化学与生活、环境、社会密切相关.下列有关说法中不正确的是( )
| A. | 计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品 | |
| B. | 新型能源汽车的推广有助于减少光化学烟雾的产生 | |
| C. | 2008年北京奥运会开幕式上的“脚印”等焰火主要是利用了“焰色反应”的现象 | |
| D. | 2008年我国开始实施“限塑令”,目的是限制购物塑料袋的使用,减少“白色污染” |
2.下列叙述不正确的是( )
| A. | 10mL O2与10mL CO2含有相同的分子数 | |
| B. | 0.5 mol H2O与0.5 mol CO含有相同的分子数 | |
| C. | 同温同压下,10mL N2和10mL NO含有相同的原子数 | |
| D. | 1 mol Fe和1 mol Cu在常温下所含的原子数相同,但体积不同 |
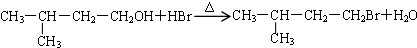 ;
; ;
; .
.