题目内容
7.下列有机物分子所有原子不在同一平面上的是( )| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
分析 在常见的有机化合物中,甲烷是正四面体结构,乙烯和苯都是平面型结构,乙炔是直线型结构,据此对各选项中的有机物进行判断分子中各原子不在同一平面.
解答 解:A.甲烷为正四面体结构,乙烷相当于甲烷中的1个H被甲基取代的产物,故所有原子不可能处于同一平面内,故A正确;
B.C2H4是平面结构,所有原子处于同一平面内,故B错误;
C.乙炔为直线型结构,所有原子处于同一平面内,故C错误;
D.苯是平面结构,所有原子都处于同一平面内,故D错误,
故选A.
点评 本题主要考查有机化合物的结构特点,题目难度不大,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
16.下列溶液一定呈中性的是( )
| A. | 使石蕊试液呈紫色的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | pH=7的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
17.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1mol/L pH=9的NaNO2溶液中C(Na+)>C(NO2-)>C(OH-)>C(H+) | |
| B. | 0.1mol/LNa2S溶液中:2C(Na+)=C(S2-)+C(HS-)+C(H2S) | |
| C. | 等PH的氨水、NaOH溶液、Ba(OH)2溶液中:C(NH4+)=C(Na+)=C(Ba2+) | |
| D. | 向NH4HCO3溶液中滴加NaOH溶液至pH=7:C(NH4+)+C(Na+)=C(HCO32-)+C(CO32-) |
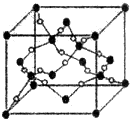 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.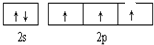 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;