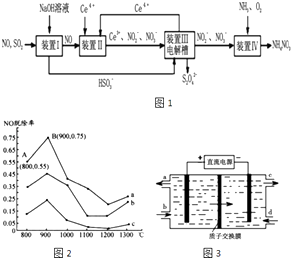
题目内容
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n].研究发现,当a=b时净水效果最好.工艺流程如下(部分操作和产物略):![]()
(1)A12O3与H2SO4发生反应的离子方程式是 .
(2)测得滤液中 ![]() >1.加入FeSO47H2O和H2O2的作用是(结合化学用语说明) .
>1.加入FeSO47H2O和H2O2的作用是(结合化学用语说明) .
(3)将溶液A电解得到液体聚合硫酸铝铁.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)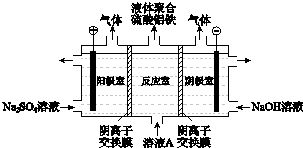
①阴极室的电极反应式是 .
②电解过程阳极室溶液pH的变化是(填“增大”、“减小”或“不变”).
③简述在反应室中生成液体聚合硫酸铝铁的原理 .
【答案】
(1)Al2O3+6H+=2Al3++3H2O
(2)2Fe2++H2O2+2H+=2Fe3++2H2O,补充Fe3+
(3)2H++2e﹣=H2↑;减小;电解过程中反应室中的SO42﹣通过阴离子交换膜进入阳极室,阴极室中的OH﹣通过阴离子交换膜进入反应室,生成聚合硫酸铝铁
【解析】解:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,所以答案是:Al2O3+6H+=2Al3++3H2O;(2)因滤液中 ![]() >1,加入绿矾晶体引入Fe2+ , 并利用过氧化氢氧化得到Fe3+ , 补充溶液里的Fe3+ , 使
>1,加入绿矾晶体引入Fe2+ , 并利用过氧化氢氧化得到Fe3+ , 补充溶液里的Fe3+ , 使 ![]() =1,其中氧化Fe2+的离子反应式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O,补充Fe3+;(3)①阴极上氢离子得电子生成氢气,则阴极的电极反应式为:2H++2e﹣=H2↑;所以答案是:2H++2e﹣=H2↑;②阳极上水电离的OH﹣被氧化,促进水的电离,阳极周围溶液里H+浓度增大,溶液的pH减小,所以答案是:减小;③阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m﹣n;所以答案是:电解过程中反应室中的SO
=1,其中氧化Fe2+的离子反应式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O,补充Fe3+;(3)①阴极上氢离子得电子生成氢气,则阴极的电极反应式为:2H++2e﹣=H2↑;所以答案是:2H++2e﹣=H2↑;②阳极上水电离的OH﹣被氧化,促进水的电离,阳极周围溶液里H+浓度增大,溶液的pH减小,所以答案是:减小;③阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m﹣n;所以答案是:电解过程中反应室中的SO ![]() ﹣通过阴离子交换膜进入阳极室,阴极室中的OH﹣通过阴离子交换膜进入反应室,生成聚合硫酸铝铁.
﹣通过阴离子交换膜进入阳极室,阴极室中的OH﹣通过阴离子交换膜进入反应室,生成聚合硫酸铝铁.

 名校课堂系列答案
名校课堂系列答案【题目】草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10﹣2、K2=5.4×10﹣5 . 常温下几种草酸盐溶液的pH见下表:
编号 | ① | ② | ③ |
溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
pH | 3.1 | 8.1 | 未测定 |
下列溶液中离子的物质的量浓度关系正确的是( )
A.①中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.②中:c(K+)>c(C2O ![]() )>c(HC2O
)>c(HC2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.③中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
D.③中:2c(OH﹣)+c(C2O ![]() )=3c(H2C2O4)+c(HC2O
)=3c(H2C2O4)+c(HC2O ![]() )+2c(H+)
)+2c(H+)