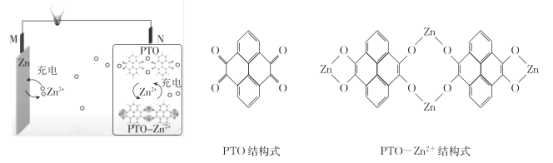
题目内容
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示,含量第一、第三、第四的三种元素用字母代号表示。回答下列问题:

(1)X的名称为 _________,Z的元素符号为 _______ 。
(2)硅的氧化物与氢氟酸反应的化学方程为________,Y元素的单质与Z3X4反应的化学方程式为 ___________,23.2 g Z3X4完全反应时,转移的电子数目为__________。(用NA代表阿伏加德罗常数的值)
(3)NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。
已知:CO燃烧热的ΔH1=-283.0kJ·mol-1,N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
(4)以MnSO4溶液为原料可通过电解法制备超级电容材料MnO2,其装置如图所示:

①则电解过程中阳极电极反应为_________。
②电解一段时间后,阴极溶液中H+的物质的量____________(填“变大”、“减小”或者“不变”)。
【答案】氧 Fe SiO2 + 4HF = SiF4↑ + 2H2O 8Al+3Fe3O4![]() 4Al2O3+9Fe 0.8NA -746.5KJ/mol Mn2+-2e-+2H2O=MnO2+4H+ 不变
4Al2O3+9Fe 0.8NA -746.5KJ/mol Mn2+-2e-+2H2O=MnO2+4H+ 不变
【解析】
(1)地壳中元素含量由多到少分别为氧、硅、铝、铁、钙、钠、钾、镁、氢;
(2)硅的氧化物与氢氟酸反应生成四氟化硅气体和水;Al与Fe3O4发生铝热反应;
(3)根据盖斯定律解题;
(4)根据阳极氧化失电子,阴极还原得电子书写电极反应,判断离子物质的量的变化;
(1)地壳中元素含量由多到少分别为氧、硅、铝、铁、钙、钠、钾、镁、氢;X地壳中含量最高,名称为氧,Z在地壳中含量位于第四位,元素符号为Fe;
答案:氧 Fe
(2)硅的氧化物与氢氟酸反应生成四氟化硅和水,化学方程式为SiO2 + 4HF = SiF4↑ + 2H2O,Al与Fe3O4发生铝热反应生成Al2O3和Fe,反应的化学方程式为8Al+3Fe3O4![]() 4Al2O3+9Fe,23.2 g Fe3O4完全反应时转移的电子数目为
4Al2O3+9Fe,23.2 g Fe3O4完全反应时转移的电子数目为![]() =0.8NA;
=0.8NA;
答案:SiO2 + 4HF = SiF4↑ + 2H2O 8Al+3Fe3O4![]() 4Al2O3+9Fe 0.8NA
4Al2O3+9Fe 0.8NA
(3)已知:CO燃烧热的ΔH1=-283.0kJ·mol-1,热化学方程式为2CO(g)+O2(g)=2CO2(g)ΔH1=-576kJ·mol-1①,N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.5kJ·mol-1②,根据盖斯定律①-②得2NO(g)+2CO(g)
2NO(g) ΔH2=+180.5kJ·mol-1②,根据盖斯定律①-②得2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH=-746.5KJ/mol;
N2(g)+2CO2(g) ΔH=-746.5KJ/mol;
答案:-746.5KJ/mol
(4)①根据Mn的化合价,从+2价→+4价,失电子发生氧化反应,则阳极电极反应式为Mn2+-2e-+2H2O=MnO2+4H+;
②阴极上2H++2e-=H2,若电解过程中外电路转移amole-,则阴极消耗amolH+,同时有amolH+由阳极移向阴极,故阴极溶液中H+的物质的量不会改变;
答案:Mn2+-2e-+2H2O=MnO2+4H+ 不变

 阅读快车系列答案
阅读快车系列答案【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
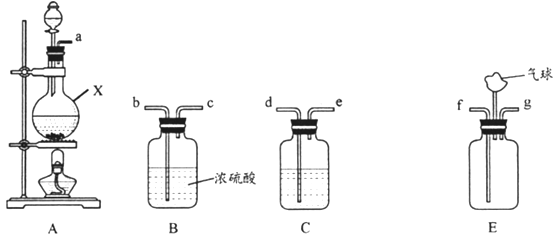
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。

①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
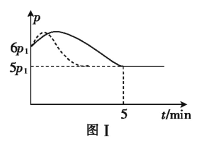
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。