题目内容
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
| | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
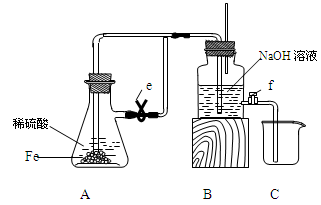
| C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
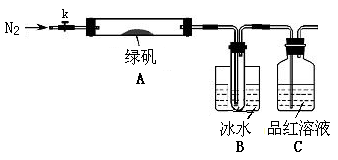
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
D
| A | 2Fe3++2I-=I2+2Fe2+,碘单质使淀粉溶液变蓝 | 错误 |
| B | 铁锈的主要成分是Fe2O3 | 错误 |
| C | 铁与稀硝酸反应生成的气体为NO,不能得到氢气 | 错误 |
| D | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | 正确 |

练习册系列答案
相关题目
 Fe2++Cr3+
Fe2++Cr3+