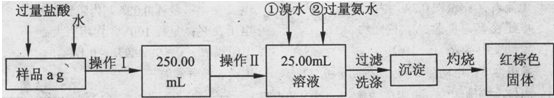
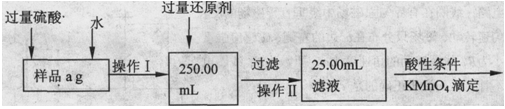
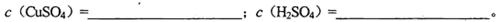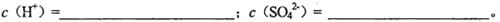题目内容
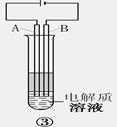
某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题:
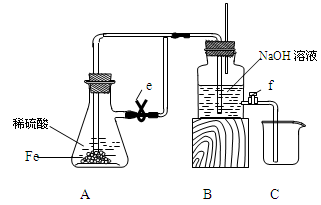
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。

(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
(1)Fe + 2H+ = Fe2+ + H2↑ 导管口有气泡冒出
(2)A中溶液进入B,立即产生白色沉淀 H+ + OH-= H2O, Fe2+ + 2OH-= Fe(OH)2↓
(3)沉淀逐渐变成灰绿色,最终变成红褐色, 4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
(2)A中溶液进入B,立即产生白色沉淀 H+ + OH-= H2O, Fe2+ + 2OH-= Fe(OH)2↓
(3)沉淀逐渐变成灰绿色,最终变成红褐色, 4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
试题分析:Fe与稀硫酸发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑其离子方程式为:Fe + 2H+ = Fe2+ + H2↑。A中产生的气体通过导气管到B的溶液中,会看到在导气管口产生气泡。(2)数分钟后夹上夹子e,A中还在继续反应产生气体,使容器A的气压增大,这时A中反应产生的FeSO4就会被压入到B容器中,与NaOH溶液反应产生白色Fe(OH)2沉淀。B中反应的离子方程式是H+ + OH-= H2O,Fe2+ + 2OH-= Fe(OH)2↓(3)如果开启活塞f放掉约2/3液体,因为空气的进入,白色不稳定的Fe(OH)2会被氧化为红褐色的Fe(OH)3.因此此时试剂瓶B中可能出现的现象是沉淀逐渐变成灰绿色,最终变成红褐色。反应的化学方程式是4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3。2的制取与性质的知识。

练习册系列答案
相关题目
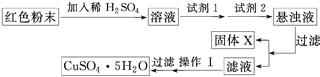
 CuSO4和1.0 mol
CuSO4和1.0 mol