题目内容
(10分)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图 ;其中元素W在周期表中的位置 。
(2)用电子式表示X在空气中生成的氧化物的形成过程: 。
(3)X、Y、Z、W的原子半径由大到小的顺序为: 。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式: 。
(5)写出Z与氢元素形成的10电子微粒化学式 (任写两种)。
(6)元素X与元素Y相比,金属性较强的是 (用元素符号表示),请举一例实验事实证明这一结论 。
(1)请写出元素Y的原子结构示意图 ;其中元素W在周期表中的位置 。
(2)用电子式表示X在空气中生成的氧化物的形成过程: 。
(3)X、Y、Z、W的原子半径由大到小的顺序为: 。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式: 。
(5)写出Z与氢元素形成的10电子微粒化学式 (任写两种)。
(6)元素X与元素Y相比,金属性较强的是 (用元素符号表示),请举一例实验事实证明这一结论 。
(10分)(1) (1分) 第三周期第ⅦA族(1分)
(1分) 第三周期第ⅦA族(1分)
(2) (1分)
(1分)
(3)Na>Al>Cl>N (1分) (4)Cl2+ 2OH-= Cl-+ ClO-+H2O (2分)
(5)NH3、NH4+、NH2-(2分)
(6)Na (1分) Na与水反应要比Al剧烈(1分)(其它合理答案也可)
 (1分) 第三周期第ⅦA族(1分)
(1分) 第三周期第ⅦA族(1分)(2)
 (1分)
(1分)(3)Na>Al>Cl>N (1分) (4)Cl2+ 2OH-= Cl-+ ClO-+H2O (2分)
(5)NH3、NH4+、NH2-(2分)
(6)Na (1分) Na与水反应要比Al剧烈(1分)(其它合理答案也可)
试题分析:Z的原子次外层的电子数为2,最高价是+5价,所以Z是氮元素。核电荷数按照Z、X、Y、W的顺序增大,且W、X原子次外层电子数为8,所以根据其最高价可知,W是氯元素,X是Na,则Y是Al。
(1)Al的原子序数是13,所以原子结构示意图为
 。氯元素的原子序数是17,所以位于第三周期第ⅦA族。
。氯元素的原子序数是17,所以位于第三周期第ⅦA族。(2)钠在空气中生成氧化钠,含有离子键的离子化合物,所以其形成过程是
 。
。(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以X、Y、Z、W的原子半径由大到小的顺序为Na>Al>Cl>N。
(4)氯气和氢氧化钠溶液反应的离子方程式是Cl2+ 2OH-= Cl-+ ClO-+H2O。
(5)氮元素和氢元素形成的10电子微粒有NH3、NH4+、NH2-等。
(6)由于钠极易和水生成氢气和氢氧化钠,而A和水是不反应的,所以钠的金属性强于铝的金属性。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,对学生的能力要求较高。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
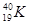 和
和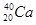
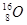 、
、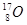 和
和