题目内容
常温下,将 pH=3 的硫酸与 pH=9 的 NaOH 溶液混合,若要得到 pH = 7 的溶液,混合时硫酸与 NaOH 溶液的体积比为( )
A.1: 200 B. 200 : 1 C. 100 : 1 D.1:100
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2C O2(g) △H=-566.0kJ·mol-1
O2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。

(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。



 2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )

 CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。 2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )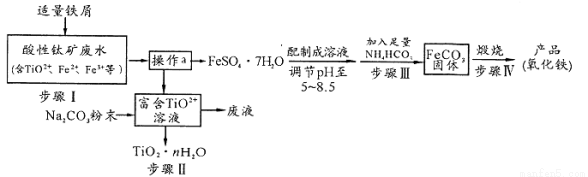
 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。 。在实际工业生产中,加入沉淀剂BaCl
。在实际工业生产中,加入沉淀剂BaCl 2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 