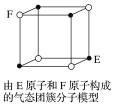
题目内容
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
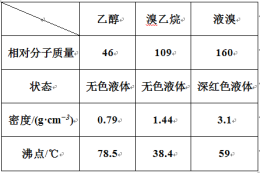
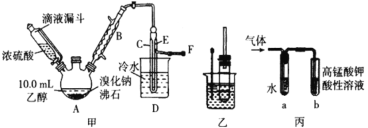
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为:___。 |
(2)将此4.5g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为:____。 |
(3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况)。 | (3)写出A中含有的官能团(用结构简式表示)____。 |
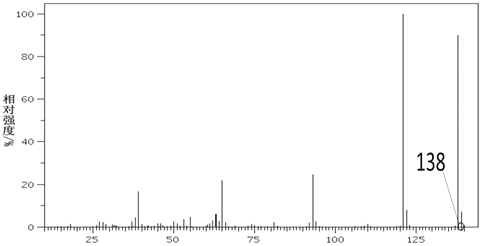
(4)A的核磁共振氢谱如图: | (4)综上所述,A的结构简式为________。 |
【答案】90 C3H6O3 -COOH、-OH ![]()
【解析】
根据气体的密度之比等于气体的摩尔质量之比可推知A的相对分子质量,进而计算出n(A),n(C)=n(CO2),n(H)=2n(H2O),根据质量守恒关系计算出n(O),根据各量的关系,可以求出A的分子式;A与NaHCO3反应放出 CO2,则说A中应含有羧基,与足量金属钠反应生成 H2,说明A中还含有羟基,核磁共振氢谱中有4个吸收峰,面积之比为1:1:1:3,从而确定A的结构简式。
(1)根据气体的密度之比等于气体的摩尔质量之比可知,A的相对分子质量为:45×2=90;故答案为:90;
(2)由题意可推知:n(A)=![]() =0.05 mol,n(C)=n(CO2)=
=0.05 mol,n(C)=n(CO2)=![]() =0.15 mol,A分子中C原子为3,n(H)=2n(H2O)=2×
=0.15 mol,A分子中C原子为3,n(H)=2n(H2O)=2×![]() =0.3 mol,A分子中H原子为6,n(O)=
=0.3 mol,A分子中H原子为6,n(O)=![]() =0.15 mol,A分子中O原子为3,所以A的分子式为C3H6O3,故答案为:C3H6O3;
=0.15 mol,A分子中O原子为3,所以A的分子式为C3H6O3,故答案为:C3H6O3;
(3)0.05 mol A与NaHCO3反应放出0.05 mol CO2,则说A中应含有一个羧基,而与足量金属钠反应则生成0.05 mol H2,说明A中还含有一个羟基,故答案为:-COOH、-OH;
(4)核磁共振氢谱中有4个吸收峰,面积之比为1:1:1:3,可知A中应含有4种不同环境的氢原子,综上所述,A的结构简式:![]() 。
。
故答案为:![]() 。
。

【题目】苯乙烯是一种重要的化工原料。
![]() 工业上可用乙苯催化脱氢方法制备苯乙烯
工业上可用乙苯催化脱氢方法制备苯乙烯
![]() 已知部分化学键的键能如下:
已知部分化学键的键能如下:
化学键 |
|
|
|
|
键能 | 412 | 348 | 612 | 436 |
则![]() +H2(g)的
+H2(g)的![]() ________
________![]() 。
。
![]() 实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂
实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂![]() 水蒸气不参加反应
水蒸气不参加反应![]() 。在一定压强、
。在一定压强、![]() 的条件下,乙苯的平衡转化率随着
的条件下,乙苯的平衡转化率随着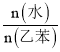 的增大而________
的增大而________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________
。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
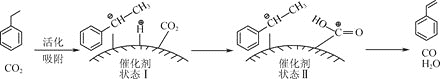
![]() 苯乙烯可由乙苯和
苯乙烯可由乙苯和![]() 催化脱氢制得。其反应历程如下:
催化脱氢制得。其反应历程如下:
乙苯平衡转化率与![]() 的关系如图所示,当
的关系如图所示,当![]() 时,乙苯平衡转化率随着
时,乙苯平衡转化率随着![]() 增大而增大,其原因是__________,当
增大而增大,其原因是__________,当![]() 时,乙苯平衡转化率随着
时,乙苯平衡转化率随着![]() 增大反而减小,其原因是____________。
增大反而减小,其原因是____________。

![]() 研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下
研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下![]() 的
的![]() ,则外电路中理论上转移电子的物质的量为________。
,则外电路中理论上转移电子的物质的量为________。