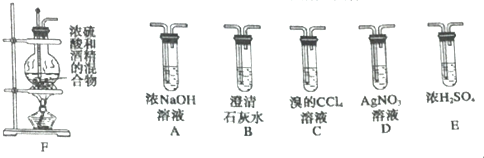
题目内容
8.E,F,Z,W为短周期元素,原子半径E>F>Z>W,E,F,Z处于同一周期,Z、W处于同一主族,E、F、Z原子序数之和为40,E是短周期中除稀有气体元素外半径最大的元素.下列说法正确的是( )| A. | 若E、F、W形成的化合物EFW2,则E与W可以形成化合物E2W2 | |
| B. | F的最高价氧化物对应的水化物一定能与氢氧化钠溶液反应 | |
| C. | 稳定性:Z的氢化物>W的氢化物 | |
| D. | 沸点:Z的氢化物>W的氢化物 |
分析 E、F、Z、W为短周期元素,E是短周期中除稀有气体元素外半径最大的元素,则E为Na;E、F、Z处于同一周期,E、F、Z原子序数之和为40,则F、Z的原子序数之和=40-11=29,原子半径E>F>Z>W,F可能为Mg、Al、Si,对应的Z可能为Cl、S、P,由于Z、W处于同一主族,相应的W为F、O、N,据此解答.
解答 解:E、F、Z、W为短周期元素,E是短周期中除稀有气体元素外半径最大的元素,则E为Na;E、F、Z处于同一周期,E、F、Z原子序数之和为40,则F、Z的原子序数之和=40-11=29,原子半径E>F>Z>W,F可能为Mg、Al、Si,对应的Z可能为Cl、S、P,由于Z、W处于同一主族,相应的W为F、O、N,
A、若E、F、W形成的化合物EFW2,则为NaAlO2,则钠与氧可以形成化合物Na2O2,故A正确;
B、如果F是镁,最高价氧化物对应的水化物氢氧化镁不与氢氧化钠反应,故B错误;
C、Z的非金属弱于W的非金属性,所以Z的氢化物<W的氢化物,故C错误;
D、如果Z是硫,则W是氧,它们氢化物分别是硫化氢和水,水分子间存在氢键,所以沸点:Z的氢化物<W的氢化物,故D错误;
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意元素的不确定性,难度中等.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
16.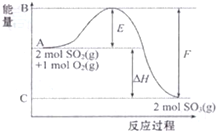 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )| A. | 该反应的反应物总能量小于生成物总能量 | |
| B. | 该反应的逆反应为吸热反应 | |
| C. | 图中△H=-99kJ•mol-1, | |
| D. | 图中字母E所示能量值表示该反应的活化能 |
13.已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0.
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1> K2(填“>”、“=”或“<”).
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.用铁触媒加快化学反应速率 B.采用较高压强(20MPa~50MPa)
C.采用较高温度(400℃~500℃) D.将生成的氨液化并及时从体系中分离出来.
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.用铁触媒加快化学反应速率 B.采用较高压强(20MPa~50MPa)
C.采用较高温度(400℃~500℃) D.将生成的氨液化并及时从体系中分离出来.
17.下列说法不正确的是( )
| A. | 水晶有固定的熔点,而普通玻璃则没有 | |
| B. | 水泥、玻璃、陶瓷属于传统的无机非金属材料 | |
| C. | 不锈钢和普通钢的组成元素完全相同,但耐腐蚀性能不同 | |
| D. | 氯化铵和单质碘在加热时有类似现象,但本质不同 |
18.符合如图的反应为( )
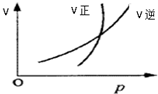

| A. | N2O4(g)?2NO2(g) | B. | CO2(g)+C(s)?2CO(g) | ||
| C. | 2SO2(g)+O2(g)?2SO3(g) | D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) |
 某温度时,在2L容器中A、B、C三种物质的物质的量浓度随时间变化关系曲线如图所示.
某温度时,在2L容器中A、B、C三种物质的物质的量浓度随时间变化关系曲线如图所示.