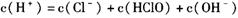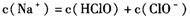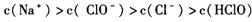题目内容
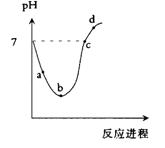
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计( )
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲=乙 | D.乙>丙>甲 |
B
试题分析:氯水中存在下列平衡:Cl2+H2O
 HCl+HClO。甲中加入NaHCO3后,NaHCO3会与酸反应。而酸性:HCl>H2CO3>HClO,所以NaHCO3先与HCl反应而不与HClO反应,由于平衡中HCl被消耗,平衡移动的原理,平衡向右移动,反应继续生成HClO,HClO浓度增大。另外HClO具有强氧化性,乙瓶中,HClO可将NaHSO3氧化,所以HClO浓度下降。丙瓶中HClO浓度不变。
HCl+HClO。甲中加入NaHCO3后,NaHCO3会与酸反应。而酸性:HCl>H2CO3>HClO,所以NaHCO3先与HCl反应而不与HClO反应,由于平衡中HCl被消耗,平衡移动的原理,平衡向右移动,反应继续生成HClO,HClO浓度增大。另外HClO具有强氧化性,乙瓶中,HClO可将NaHSO3氧化,所以HClO浓度下降。丙瓶中HClO浓度不变。点评:本题在一个新的情景下对次氯酸的性质进行了考查,难度不大,但是需要学生全面把握,综合考虑。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )