题目内容
下列有关氯水的表述不正确的是
| A.氯水可以导电,说明氯气是电解质 |
| B.氯水中含有7种微粒,可与AgNO3、FeBr2等多种物质反应 |
| C.蓝色石蕊试纸放入氯水中先变红后褪色 |
| D.向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 |
A
试题分析:A.氯气是单质,既不是电解质也不是电解质,氯气溶于水中部分与水发生反应:Cl2+H2O=HCl+HClO,生成的HCl和HClO是电解质,可以电离引起导电。B.C.氯水中含有Cl2 、H2O、HClO、H+、Cl-、OH- 、ClO-7种微粒,其中Cl-可与AgNO3反应,HClO具有强氧化性可与FeBr2反应,溶液呈酸性,HClO具有漂白性,可以使蓝色石蕊试纸先变红,继而褪色D.向氯水中加入碳酸钙粉末,使其与HCl反应,反应进一步向右进行,可以提高HClO的浓度。
点评:电解质是溶于水溶液中或在熔融状态下就能够导电的化合物,有些氧化物在水溶液中即便能导电,但也不是电解质。因为这些氧化物与水反应生成了新的能导电的物质,溶液中导电的不是原氧化物,如SO2。 常温下,氯气溶于水中部分与水发生反应:Cl2+H2O=HCl+HClO,溶液中的微粒有Cl2 、H2O、HClO、H+、Cl-、OH- 、ClO-等,据此可以判断氯水应有的性质。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
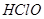 是弱酸,所以
是弱酸,所以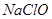 是弱电解质
是弱电解质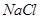 溶液均通过离子导电,是因为其溶质均为强电解质
溶液均通过离子导电,是因为其溶质均为强电解质