题目内容
6.A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为( )| A. | A2B3 | B. | BA2 | C. | AB4 | D. | B3A2 |
分析 A元素原子的L层比B元素原子的L层少3个电子,则A的L层电子应为5,应为N元素,原子核外电子数为7,B元素原子核外电子数比A元素原子核外电子总数多5个,则B的原子核外电子数应为12,为Mg元素,以此解答该题.
解答 解:A、B两元素原子的L层上有电子,则K层上肯定填满2个,而B原子核外电子总数比A原子核外电子总数多5,
所以A元素的原子的结构示意图为 ,B元素原子的结构的示意图为
,B元素原子的结构的示意图为 ,
,
即A为氮元素,B为镁元素,形成Mg3N2(氮化镁).
故选D.
点评 本题考查了原子结构和元素性质,为高频考点,侧重于学生的分析能力的考查,根据原子各个电子层上电子确定两种元素,再结合元素化合价确定二者形成的化合物,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小,且Y是地壳中含量最高的金属元素 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:D>E>B>A | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型和晶体类型完全相同 | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
11.下列各物质中,互为同系物的是( )
| A. |  与CH3-CH2-CH2-CH3 与CH3-CH2-CH2-CH3 | B. | 醋酸和十八酸 | ||
| C. | 乙二醇和甘油 | D. |  和 和 |
18.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
15.下列关于乙烯和乙烷相比较的说法中,不正确的是( )
| A. | 乙烯属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上 | |
| C. | 乙烯和乙烷燃烧现象相同,完全燃烧产物也相同 | |
| D. | 乙烯能使酸性高锰酸钾溶液褪色,乙烷不能 |
16.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y的性质稳定,而Z不能形成双原子分子.根据以上叙述,下列说法中正确的是( )
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | W不能与同族元素形成离子化合物 |
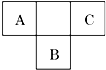 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.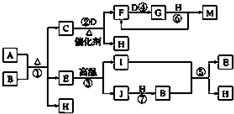 已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.
已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.