题目内容
14.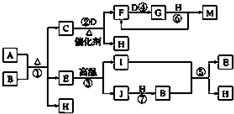 已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.
已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.(1)写出A的化学式NH4HCO3或(NH4)2CO3.I的结构式O=C=O.
(2)写出下列反应的离子方程式:
①向A溶液中加入过量的NaOH溶液,并加热NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2H2O+NH3↑ 或NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.
②气体I通入足量B溶液中CO2+Ca2++2OH-=CaCO3↓+H2O.
(3)写出反应②的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 H为无色液态,应为H2O,M为三大强酸之一,强酸为H2SO4、HCl、HNO3,反应反应②③④⑥为工业生产中重要的反应,中学中工业生产中重要的反应有硫酸工业、硝酸工业、氯碱工业、侯氏制碱、冶金工业、高温煅烧石灰石等,E的相对分子质量为100,可能为Mg3N2、KHCO3、CaCO3,由②的反应条件为催化剂加热可知,M是HNO3,则G为NO2,F为NO,C为NH3,由③反应条件能在高温条件下分解,则E为CaCO3,生成的气体I为CO2,则J为CaO,和水反应生成的B为Ca(OH)2,水和另一种气体,则C应为NH3,由转化关系可知D为O2,F为NO,G为NO2,M为HNO3,结合C、D、E、H,等物质的量的A、B充分混合后加热能恰好完全反应,能与氢氧化钙反应生成碳酸钙、可知A为NH4HCO3或(NH4)2CO3,以此解答该题.
解答 解:已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液态,应为H2O,M为三大强酸之一,强酸为H2SO4、HCl、HNO3,反应反应②③④⑥为工业生产中重要的反应,中学中工业生产中重要的反应有硫酸工业、硝酸工业、氯碱工业、侯氏制碱、冶金工业、高温煅烧石灰石等,E的相对分子质量为100,可能为Mg3N2、KHCO3、CaCO3,由②的反应条件为催化剂加热可知,M是HNO3,则G为NO2,F为NO,C为NH3,由③反应条件能在高温条件下分解,则E为CaCO3,生成的气体I为CO2,则J为CaO,和水反应生成的B为Ca(OH)2,水和另一种气体,则C应为NH3,由转化关系可知D为O2,F为NO,G为NO2,M为HNO3,结合C、D、E、H,等物质的量的A、B充分混合后加热能恰好完全反应,能与氢氧化钙反应生成碳酸钙、可知A为NH4HCO3或(NH4)2CO3,以此解答该题;
(1)上述分析可知A的化学式NH4HCO3或(NH4)2CO3,I为二氧化碳,分子的结构式为:O=C=O;
故答案为:NH4HCO3或(NH4)2CO3;O=C=O;
(2)①向A溶液中加入过量的NaOH溶液,并加热反应生成氨气,反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2H2O+NH3↑ 或NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑;
故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2H2O+NH3↑ 或NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑;
②气体I为CO2通入足量B为Ca(OH)2溶液中,反应生成碳酸钙沉淀,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(3)反应②为A为氨气的催化氧化反应生成一氧化氮,反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物的推断,题目难度较大,注意根据物质的特性作为推断的突破口,解答时注意把握化学方程式的书写,掌握物质的性质,判断反应原理是关键.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| C. | Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |
| A. | HCl、NO2、N2、粉尘 | B. | CO2、Cl2、N2、雾 | C. | SO2、NO2、CO、烟尘 | D. | CO2、NO、NH3、H2S |
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶液剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 煤的干馏得到的煤焦油中可以分离出苯及其同系物,也可以分离出乙烯、丙烯等石油化工原料 | |
| C. | 用原子吸收光谱可以确定物质中含有哪些金属元素 | |
| D. | 淀粉、麦芽糖糖水解后的最终产物都是葡萄糖 |
| A. | A2B3 | B. | BA2 | C. | AB4 | D. | B3A2 |
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
| A. | 欲配制质量分数为10%的ZnSO4溶液,将10g ZnSO4•7H2O溶解在90g水中 | |
| B. | 常温常压下,22.4L的NO2气体含有1.81×1024个原子 | |
| C. | 为鉴别KCl、AlCl3和MgCl2溶液,各取少量分别向三种溶液中滴加NaOH溶液至过量 | |
| D. | 某溶液中加入盐酸能产生使石灰水变浑浊的气体,则该溶液中一定含有CO32- |
 .
.